Пероксид магния (MgO2) представляет собой соединение магния и кислорода. Он обычно используется в сельском хозяйстве в качестве источника медленно высвобождаемого кислорода и в качестве удобрения для почвы для улучшения роста растений.
| Название ИЮПАК | Перекись магния |
| Молекулярная формула | MgO2 |
| Количество CAS | 14452-57-4 |
| Синонимы | Диоксид магния, магний; перекись, Permag, Magics, Oxy-Gen, EINECS 215-217-9 |
| ИнЧИ | InChI=1S/Mg.2O2/ч;2*1H/q+2;;/p-2 |
Свойства перекиси магния
Формула перекиси магния
Химическая формула пероксида магния – MgO2. Это означает, что одна молекула пероксида магния содержит один атом магния и два атома кислорода. Формула важна, поскольку она определяет тип и количество атомов, присутствующих в соединении, и помогает определить стехиометрию химических реакций с участием пероксида магния.
Молярная масса пероксида магния
MgO2 имеет молярную массу 56,304 г/моль. Это значит, что в одном моле MgO2 содержится 56304 грамма соединения. Молярная масса — важное свойство MgO2, поскольку она помогает определить, какое количество вещества необходимо для химических реакций.
Температура кипения перекиси магния
У MgO2 нет установленной температуры кипения, поскольку он разлагается до того, как закипит. При нагревании он разлагается на оксид магния и газообразный кислород. Это свойство MgO2 делает его полезным в качестве источника кислорода в различных приложениях.
Температура плавления пероксида магния
MgO2 имеет температуру плавления 223°C. Это означает, что при температуре выше 700°С твердое соединение превращается в жидкость. Температура плавления является важным свойством MgO2, поскольку она определяет, как соединение ведет себя при воздействии высоких температур.
Плотность пероксида магния г/мл
Плотность MgO2 составляет 2,41 г/мл. Это означает, что один миллилитр MgO2 весит 2,41 грамма. Плотность — важное свойство MgO2, поскольку она помогает определить массу данного объема соединения.
Молекулярный вес пероксида магния
Молекулярная масса MgO2 составляет 56,304 г/моль. Это означает, что одна молекула MgO2 имеет массу 56304 атомных единиц массы. Молекулярный вес — важное свойство MgO2, поскольку оно помогает определить, какое количество вещества необходимо для химических реакций.
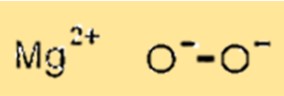
Структура пероксида магния
MgO2 имеет кристаллическую структуру, в которой ионы магния занимают октаэдрические позиции структуры решетки, а ионы кислорода — тетраэдрические позиции. Эта кристаллическая структура важна, поскольку она определяет физические и химические свойства MgO2.
| Свойство | Ценить |
| Появление | белый порошок |
| Удельный вес | 3,15 г/см³ |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 56,304 г/моль |
| Плотность | 2,41 г/мл |
| Точка плавления | 223°С |
| Точка кипения | Разлагается перед кипячением |
| Мигающая точка | Непригодный |
| Растворимость в воде | нерастворимый |
| Растворимость | Растворим в кислотах |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Непригодный |
Безопасность и опасности перекиси магния
MgO2 обычно считается безопасным при правильном обращении и использовании. Однако он может вызывать раздражение кожи, глаз и дыхательной системы. Проглатывание больших количеств может вызвать раздражение желудочно-кишечного тракта, рвоту и диарею. Важно избегать вдыхания порошка и носить защитную одежду и оборудование при работе с ним. MgO2 не горюч и не взрывоопасен, но может реагировать с некоторыми химическими веществами, такими как кислоты и сильные окислители. Во избежание случайных реакций необходимо правильное хранение и обращение. При попадании или проглатывании немедленно обратитесь за медицинской помощью.
| Символы опасности | О, Си |
| Описание безопасности | Перекись магния может вызвать раздражение кожи и глаз, а также раздражение дыхательных путей при вдыхании. Он может быть вредным при проглатывании или попадании на кожу и может привести к серьезному повреждению глаз. Также существует риск возгорания при воздействии тепла, пламени или окислителей. |
| Идентификационные номера ООН | UN1479 |
| код ТН ВЭД | 282910 |
| Класс опасности | 5.1 |
| Группа упаковки | II |
| Токсичность | Перекись магния может вызвать раздражение кожи и глаз, а также раздражение дыхательных путей при вдыхании. Он может быть вредным при проглатывании или попадании на кожу и может привести к серьезному повреждению глаз. Также существует риск возгорания при воздействии тепла, пламени или окислителей. |
Методы синтеза пероксида магния
Существует несколько методов синтеза MgO2, каждый из которых имеет свои преимущества и недостатки.
Один метод включает реакцию между MgO и перекисью водорода . В этом методе вы смешиваете MgO с небольшим количеством воды до образования пасты, затем добавляете перекись водорода , перемешивая смесь. Полученный продукт — MgO2 и вода.
Другой метод включает реакцию между Mg(OH)2 и перекисью водорода . Химик растворяет Mg(OH)2 в воде для получения раствора, затем перемешивает смесь, медленно добавляя перекись водорода . Полученный продукт — MgO2 и вода.
Третий метод включает прямую реакцию между металлическим магнием и газообразным кислородом при высоких температурах. Этот метод требует специального оборудования и не так широко используется, как другие методы.
Использование перекиси магния
MgO2 находит различное применение в различных отраслях промышленности, в том числе:
- Применение в окружающей среде – используется в качестве соединения, выделяющего кислород, при восстановлении почвы и грунтовых вод для разрушения загрязняющих веществ.
- Сельское хозяйство. Используется в качестве удобрения и кондиционера почвы из-за свойств медленного высвобождения кислорода, которые ускоряют рост растений.
- Медицинский – используется в некоторых рецептурах зубных паст в качестве отбеливающего и оксигенирующего средства для здоровья полости рта.
- Химическое производство – используется при производстве специальных химикатов, таких как эпоксидные смолы, перкислоты и перэфиры.
- Пищевая промышленность – используется в качестве отбеливателя в муке и других пищевых продуктах.
- Текстильная промышленность – используется в качестве отбеливателя в текстильном производстве.
- Очистка воды – используется для очистки воды путем выделения кислорода и расщепления органических соединений.
Вопросы:
Вопрос: Для чего используется перекись магния?
Ответ: MgO2 используется в различных отраслях промышленности, таких как экология, сельское хозяйство, медицина, химическое производство, пищевая промышленность, текстильная промышленность и очистка воды.
Вопрос: Какие продукты получаются при смешивании перекиси водорода и сульфата магния?
Ответ: При смешивании H2O2 и сульфата магния образуются MgO2, вода и газообразный кислород.
Вопрос: Используется ли перекись магния в лабораториях?
Ответ: Да, MgO2 используется в лабораториях для различных целей, таких как химические реакции, очистка воды и санитария окружающей среды.
Вопрос: Разлагает ли магний перекись водорода?
Ответ: Магний сам по себе не расщепляет H2O2. Однако магний может реагировать с H2O2 в присутствии катализатора, такого как йодид калия, с выделением газообразного кислорода.
Вопрос: Что из перечисленного не является правильной формульной единицей? k2o mgo2 al2o3 ооо
О: Mgo2 не является правильной формульной единицей. Правильная формульная единица оксида магния — MgO.
Вопрос: Каковы продукты этой совместной реакции? mgo + co2 mgo3 + c mgco3 mgo2 mgo + o2 co2 + o2
Ответ: Продуктом совместной реакции mgo и CO2 является mgco3.
Вопрос: Жидкий, газообразный или твердый Mgo2?
Ответ: Mgo2 представляет собой твердое соединение.
