Пентасульфид фосфора (P2S5) представляет собой соединение, состоящее из двух атомов фосфора и пяти атомов серы. Он используется в различных областях, включая производство инсектицидов и смазочных материалов.
| Название ИЮПАК | Пентасульфид фосфора |
| Молекулярная формула | П2С5 |
| Количество CAS | 1314-80-3 |
| Синонимы | сульфид фосфора (V); пентасульфид дифосфора; сульфид фосфора; Пентасульфированный фосфор |
| ИнЧИ | ИнЧИ=1С/2П.5С |
Свойства пентасульфида фосфора
Формула пентасульфида фосфора
Формула пентасульфида фосфора: P2S5. Он состоит из двух атомов фосфора, связанных с пятью атомами серы.
Молярная масса пентасульфида фосфора
Молярную массу пентасульфида дифосфора можно рассчитать путем сложения атомных масс составляющих элементов. Атомная масса фосфора (P) составляет примерно 30,97 г/моль, а серы (S) — примерно 32,07 г/моль. Таким образом, молярная масса P2S5 составляет примерно 222,27 г/моль.
Температура кипения пентасульфида фосфора
Пентасульфид дифосфора имеет температуру кипения примерно 514 градусов по Цельсию (957 градусов по Фаренгейту). При этой температуре соединение претерпевает фазовый переход из жидкости в газ.
Пентасульфид фосфора Температура плавления
Температура плавления пентасульфида дифосфора составляет примерно 280 градусов Цельсия (536 градусов по Фаренгейту). Это температура, при которой соединение переходит из твердого состояния в жидкое.
Плотность пентасульфида фосфора г/мл
Плотность пентасульфида дифосфора составляет примерно 2,02 г/мл. Это указывает на то, что соединение относительно плотное, с высокой массой единицы объема.
Пентасульфид фосфора Молекулярный вес
Молекулярная масса пентасульфида дифосфора, представляющая собой сумму атомных масс составляющих его элементов, составляет примерно 222,27 г/моль.
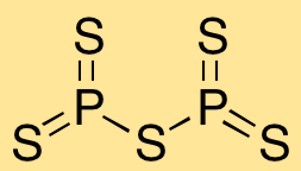
Структура пентасульфида фосфора
Пентасульфид дифосфора имеет молекулярную структуру, в которой два атома фосфора связаны с пятью атомами серы. Расположение атомов образует треугольную бипирамидальную форму с атомами фосфора в центре и окружающими их атомами серы.
Растворимость пентасульфида фосфора
Пентасульфид дифосфора плохо растворим в воде, а это означает, что он растворяется лишь в ограниченной степени. Однако он более растворим в органических растворителях, таких как бензол и сероуглерод.
| Появление | Желтое твердое вещество |
| Удельный вес | 2.02 |
| Цвет | ЖЕЛТЫЙ |
| Запах | Резкий запах |
| Молярная масса | 222,27 г/моль |
| Плотность | 2,02 г/мл |
| Точка плавления | 280°С (536°Ф) |
| Точка кипения | 514°С (957°Ф) |
| Мигающая точка | Нет в наличии |
| Растворимость в воде | Плохо растворим |
| Растворимость | Растворим в органических растворителях, таких как бензол и сероуглерод. |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | Нет в наличии |
| рН | Нет в наличии |
Безопасность и опасность пентасульфида фосфора
Пентасульфид дифосфора представляет собой ряд рисков для безопасности, поэтому при обращении с ним следует соблюдать осторожность. При контакте или вдыхании он может вызвать сильное раздражение и ожоги кожи, глаз и дыхательной системы. Следует избегать прямого контакта с составом и использовать защитные перчатки, очки и респираторное оборудование. Он также легко воспламеняется и может воспламениться при воздействии тепла или пламени, образуя токсичные оксиды серы. Необходимо правильное хранение вдали от источников возгорания. Кроме того, пентасульфид дифосфора не следует смешивать с водой или химически активными веществами, поскольку он может выделять легковоспламеняющиеся или токсичные газы. Правильная вентиляция и соблюдение протоколов безопасности имеют решающее значение при работе с этим составом.
| Символы опасности | Легковоспламеняющийся, Раздражающий |
| Описание безопасности | Вызывает серьезные ожоги кожи и повреждения глаз. Вреден при вдыхании. Легковоспламеняющееся твердое вещество. |
| Идентификационные номера ООН | ООН 1340 |
| код ТН ВЭД | 2812120000 |
| Класс опасности | 4,2 (легковоспламеняющееся твердое вещество), 8 (коррозионное) |
| Группа упаковки | II |
| Токсичность | Токсичный |
Методы синтеза пентасульфида фосфора
Для синтеза пентасульфида дифосфора можно использовать разные методы.
Распространенный метод синтеза пентасульфида дифосфора включает совместное нагревание элементарного фосфора и серы в контролируемой среде, обычно в герметичном контейнере. Высокая температура облегчает реакцию, приводящую к образованию пентасульфида дифосфора.
Другой метод включает смешивание трисульфида фосфора (P4S3) с избытком серы и нагревание смеси для ускорения реакции. Избыточная сера соединяется с трисульфидом фосфора, в результате чего образуется пентасульфид дифосфора.
Реакция пентахлорида фосфора (PCl5) с сероводородом (H2S) в присутствии подходящего растворителя, например сероуглерода, позволяет получить пентасульфид дифосфора. В результате реакции образуется пентасульфид дифосфора и в качестве побочного продукта выделяется газообразный хлористый водород (HCl) .
Пожалуйста, соблюдайте осторожность при использовании этих синтетических методов из-за опасной природы используемых реагентов и продуктов. Обеспечьте соответствующие меры безопасности, такие как использование соответствующего защитного оборудования и работа в хорошо проветриваемых помещениях во время процесса синтеза.
Использование пентасульфида фосфора
Пентасульфид дифосфора благодаря своим уникальным свойствам находит применение в различных отраслях промышленности и процессах. Вот некоторые из его применений:
- Производство инсектицидов. Производители используют пентасульфид дифосфора в качестве ключевого ингредиента при производстве инсектицидов, особенно тех, которые предназначены для борьбы с такими вредителями, как комары и клещи.
- Смазочная присадка: компании добавляют пентасульфид дифосфора в смазочные материалы в качестве добавки для улучшения их противозадирных и противоизносных свойств. Эта добавка улучшает смазочные характеристики и защищает машины в условиях высоких нагрузок.
- Химический синтез: Пентасульфид дифосфора выступает в качестве реагента в ряде химических реакций, таких как синтез тионилхлорида (SOCl2), широко используемого в органическом синтезе.
- Фармацевтическая промышленность. Фармацевтическая промышленность использует пентасульфид дифосфора в процессах исследований и разработок для синтеза конкретных соединений и промежуточных продуктов.
- Извлечение металлов. В металлургических процессах пентасульфид дифосфора используется для извлечения некоторых металлов, особенно меди и цинка, из руд. Он помогает удалить примеси и облегчает очистку металлов.
- Производство красителей и пигментов. Пентасульфид дифосфора играет роль в синтезе различных красителей и пигментов, служа ключевым строительным блоком их химической структуры.
- Боевые отравляющие вещества. Исторически пентасульфид дифосфора использовался при производстве боевых отравляющих веществ. Однако международные договоры строго регулируют и контролируют его использование в этих целях.
Важно отметить, что из-за опасного характера пентасульфида дифосфора при его обращении, хранении и утилизации необходимо соблюдать соответствующие меры безопасности и протоколы.
Вопросы:
Вопрос: Что такое димер пентасульфида фосфора?
A: Димер пентасульфида дифосфора относится к молекулярной структуре двух молекул пентасульфида фосфора, химически связанных друг с другом.
Вопрос: Какова энтропия пентасульфида фосфора?
Ответ: Энтропия пентасульфида дифосфора относится к измерению его молекулярного беспорядка или хаотичности при данной температуре.
Вопрос: Какова энтальпия пентасульфида фосфора?
Ответ: Энтальпия пентасульфида дифосфора относится к содержанию тепла или изменению энергии, связанному с его химическими реакциями или превращениями.
Вопрос: Что такое P2S5?
Ответ: P2S5 — это молекулярная формула пентасульфида дифосфора, соединения, состоящего из двух атомов фосфора, связанных с пятью атомами серы.
Вопрос: Сколько граммов серы содержится в 45,0 г P2S5?
Ответ: 45,0 г P2S5 содержат примерно 28,13 г серы.
Вопрос: Сколько молекул P2S5 вам нужно, чтобы получить 222 грамма?
Ответ: Для получения 222 граммов необходимо примерно 1,54 x 10^23 молекул P2S5.
Вопрос: Как называется P2S5?
Ответ: Название P2S5 — пентасульфид фосфора.
Вопрос: Является ли P2S5 слабым электролитом?
О: Нет, P2S5 не является слабым электролитом; это неэлектролит.
Вопрос: Как узнать, что размер частиц P2S5 неправильный?
Ответ: Неправильный размер частиц P2S5 можно определить, наблюдая отклонения от ожидаемых физических свойств и поведения соединения.
Вопрос: Что такое P2S5 очем2?
Ответ: «ochem2» не является признанным термином или обозначением P2S5 в области органической химии.
Вопрос: Как называется соединение P2S5?
Ответ: Соединение P2S5 называется пентасульфидом дифосфора.
Вопрос: Что такое P2S5 в химии?
Ответ: В химии P2S5 представляет собой молекулярную формулу пентасульфида дифосфора, соединения, используемого в различных приложениях и химических реакциях.
