Оксид фосфора (P2O5) представляет собой химическое соединение. Он образуется из соединения двух атомов фосфора и пяти атомов кислорода.
| Название ИЮПАК | Пятиокись фосфора |
| Молекулярная формула | P2O5 |
| Количество CAS | 1314-56-3 |
| Синонимы | Фосфорный ангидрид, оксид фосфора (V), пятиокись дифосфора. |
| ИнЧИ | ИнЧИ=1С/2О.П2/с2*1-3-2 |
Свойства оксида фосфора
Формула оксида фосфора
Формула пятиокиси дифосфора: P2O5. Он состоит из двух атомов фосфора и пяти атомов кислорода. Эта химическая формула представляет соотношение элементов в соединении.
оксид фосфора Молярная масса
Молярная масса пятиокиси дифосфора (P2O5) рассчитывается путем сложения атомных масс составляющих его элементов. Фосфор имеет атомную массу примерно 31,0 грамм на моль, а атомная масса кислорода составляет примерно 16,0 грамм на моль. Таким образом, молярная масса P2O5 составляет примерно 141,9 грамма на моль.
Температура кипения оксида фосфора
Пятиокись дифосфора не имеет определенной температуры кипения. Вместо этого при нагревании он вступает в химическую реакцию, превращаясь в фосфорную кислоту (H3PO4) и выделяя при этом тепло. Следовательно, он не имеет четко определенной температуры кипения, как многие другие соединения.
Температура плавления оксида фосфора
Пятиокись дифосфора (P2O5) имеет температуру плавления примерно 340 градусов по Цельсию (644 градуса по Фаренгейту). При этой температуре твердое соединение переходит в жидкое состояние. Важно отметить, что пятиокись дифосфора очень гигроскопична, то есть легко впитывает влагу из воздуха.
Плотность оксида фосфора, г/мл
Плотность пятиокиси дифосфора составляет примерно 2,39 грамма на миллилитр (г/мл). Плотность — это мера массы единицы объема, и эта величина указывает, насколько тяжело или компактно вещество. Плотность пятиокиси дифосфора влияет на его физические свойства и поведение в различных областях применения.
Молекулярный вес оксида фосфора
Молекулярная масса пятиокиси дифосфора (P2O5) составляет примерно 141,9 грамма на моль. Это значение представляет собой сумму атомных масс фосфора и кислорода в соединении. Молекулярная масса часто используется в расчетах, связанных с химическими реакциями и стехиометрией соединений.
Структура оксида фосфора
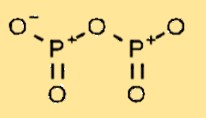
Пентаоксид дифосфора имеет молекулярную структуру, состоящую из двух атомов фосфора, связанных с пятью атомами кислорода. Расположение атомов образует циклическую структуру, в которой каждый атом фосфора связан с двумя атомами кислорода и имеет двойную связь с соседним атомом фосфора.
Растворимость оксида фосфора
Пятиокись фосфора не растворяется в воде. Он энергично реагирует с водой с образованием фосфорной кислоты, выделяя тепло. Однако он растворим в некоторых органических растворителях, таких как сероуглерод и хлороформ. Характеристики растворимости пентоксида дифосфора играют роль в его химической активности и применении.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 2,39 г/мл |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Молярная масса | 141,9 г/моль |
| Плотность | 2,39 г/мл |
| Точка плавления | 340°С (644°Ф) |
| Точка кипения | Реагирует с образованием фосфорной кислоты |
| Мигающая точка | Непригодный |
| Растворимость в воде | Реагирует с водой с образованием фосфорной кислоты. |
| Растворимость | Растворим в органических растворителях, таких как сероуглерод, хлороформ. |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Непригодный |
Безопасность и опасность оксида фосфора
Пятиокись дифосфора (P2O5) представляет определенный риск для безопасности, поэтому при обращении с ним следует соблюдать осторожность. Он бурно реагирует с водой, выделяя тепло и образуя фосфорную кислоту, которая может вызвать ожоги и раздражение кожи, глаз и дыхательных путей. При работе с пентоксидом дифосфора важно избегать контакта с веществом и использовать соответствующие защитные средства, такие как перчатки, очки и респиратор. Кроме того, крайне важно хранить состав в плотно закрытой таре, вдали от влаги и несовместимых материалов. Необходимо обеспечить достаточную вентиляцию, чтобы предотвратить накопление паров.
| Символы опасности | Коррозионный, вредный |
| Описание безопасности | – Вызывает серьезные ожоги кожи и повреждения глаз – Может быть вредным при проглатывании или вдыхании – Бурно реагирует с водой – Хранить вдали от влаги и несовместимых материалов |
| Идентификационные номера ООН | 1807 год |
| код ТН ВЭД | 2819.10.90 |
| Класс опасности | Класс 8 (коррозионные вещества) |
| Группа упаковки | PG II (средняя опасность) |
| Токсичность | Токсичен для водной флоры и фауны, может вызывать долгосрочные неблагоприятные последствия в водной среде. |
Методы синтеза оксида фосфора
Для синтеза пятиокиси дифосфора (P2O5) можно использовать различные методы.
Распространенный метод включает сжигание фосфора в присутствии избытка кислорода. В результате этой реакции образуется пятиокись фосфора в виде белого твердого остатка. Уравнение этого процесса: P4 + 5O2 → 2P2O5.
Другой метод включает контролируемое окисление соединений фосфора, таких как трихлорид фосфора (PCl3) или трибромид фосфора (PBr3) , с использованием кислорода или воздуха. Реакция обычно протекает при высоких температурах, в результате чего образуется пентоксид фосфора.
Чтобы получить пятиокись дифосфора, фосфорную кислоту (H3PO4) можно дегидратировать, нагревая ее при высокой температуре. Этот процесс удаляет молекулы воды и приводит к образованию пятиокиси фосфора.
Другой метод получения пятиокиси дифосфора включает термическое разложение некоторых фосфатных солей. Например, нагревание дигидрофосфата аммония (NH4H2PO4) или фосфата аммония ((NH4)3PO4) приводит к образованию пятиокиси фосфора.
При синтезе пятиокиси дифосфора крайне важно проявлять осторожность из-за его реакционной способности и выделения тепла во время специфических реакций. Следует соблюдать надлежащие меры безопасности, такие как работа в хорошо проветриваемом помещении и использование соответствующего защитного оборудования.
Эти синтетические методы открывают возможности для получения пятиокиси дифосфора, которая находит применение в различных областях, включая производство фосфорной кислоты, удобрений и химических промежуточных продуктов.
Использование оксида фосфора
Пятиокись дифосфора (P2O5) благодаря своим уникальным свойствам находит различное применение в ряде отраслей промышленности. Вот некоторые распространенные способы применения пентоксида дифосфора:
- Производство фосфорной кислоты. При производстве фосфорной кислоты широко используется пентоксид дифосфора в качестве ключевого прекурсора. Фосфорная кислота находит широкое применение в удобрениях, пищевых добавках и чистящих средствах.
- Производство удобрений: Пентаоксид дифосфора играет важную роль в производстве различных фосфорных удобрений, включая суперфосфат и удобрения на основе фосфата аммония. Эти удобрения обеспечивают растения необходимыми питательными веществами, способствующими здоровому росту.
- Химические промежуточные соединения. Синтез различных органических соединений, таких как фармацевтические препараты, пестициды и антипирены, связан с пентоксидом дифосфора как промежуточным химическим соединением.
- Осушитель: пентаоксид дифосфора имеет сильное сродство к воде и действует как осушитель. Он используется в нескольких химических реакциях для удаления воды и ускорения желаемых реакций.
- Катализатор: Пентоксид дифосфора действует как катализатор в определенных химических реакциях. Он облегчает эти реакции, уменьшая энергию активации и тем самым увеличивая скорость реакции.
- Влагопоглотитель: Гигроскопическая природа пятиокиси дифосфора делает его пригодным для использования в качестве влагопоглотителя в чувствительных к влаге приложениях. Он эффективно впитывает и удаляет влагу из окружающей среды.
- Производство стекла: в состав стекол входит пентоксид дифосфора для изменения их свойств, включая тепловое расширение и показатель преломления. Его активно используют в специальных стеклах, таких как оптические стекла и боросиликатные стекла.
- Обработка поверхности металла. При обработке поверхности металла, такой как фосфатирование, используется пентоксид дифосфора для повышения коррозионной стойкости и улучшения адгезии краски к металлическим поверхностям.
Эти разнообразные применения подчеркивают важность пентоксида дифосфора в различных отраслях промышленности, от сельского хозяйства до фармацевтики, что делает его ценным и широко полезным соединением.
Вопросы:
Вопрос: Какова степень окисления фосфора в ионе PO?
Ответ: Степень окисления фосфора в ионе PO равна +5.
Вопрос: Какова степень окисления отдельного атома фосфора в PO43-?
A: Степень окисления отдельного атома фосфора в PO43- равна +5.
Вопрос: Какова степень окисления фосфора?
Ответ: Степень окисления фосфора может варьироваться, но обычно она равна +3 или +5.
Вопрос: Как называется соединение P2O5?
A: Название соединения P2O5 — пятиокись фосфора (V).
Вопрос: Что такое P2O5?
Ответ: P2O5 — это химическое соединение, называемое пятиокисью фосфора (V).
Вопрос: Как правильно называть P2O5?
Ответ: Правильное название P2O5 — пятиокись фосфора (V).
Вопрос: Как называется P2O5?
Ответ: Название P2O5 — пятиокись фосфора (V).
Вопрос: Является ли P2O5 амфотерным?
О: Нет, P2O5 не амфотерен. Это кислотный оксид.
Вопрос: Что такое удобрение P2O5?
Ответ: Удобрение P2O5 относится к удобрениям, которые содержат пятиокись фосфора (V) (P2O5) в качестве источника фосфора, который важен для роста растений.
Вопрос: P2O5 является кислым или основным?
Ответ: P2O5 — кислотное соединение.
Вопрос: Является ли P2O5 ионным соединением?
Ответ: Нет, P2O5 — ковалентное соединение.
Вопрос: Как рассчитать P2O5 в удобрениях?
Ответ: Чтобы рассчитать количество P2O5 в удобрении, умножьте процентное содержание P2O5 на вес удобрения.
Вопрос: Свойства растворимого P2O5?
Ответ: P2O5 плохо растворяется в воде, но легко реагирует с водой с образованием фосфорной кислоты.
Вопрос: Сколько килограммов P в 14% P2O5?
Ответ: Чтобы рассчитать количество фосфора (P) в 14% P2O5, умножьте вес удобрения на 0,14.
