Нитрат цинка (Zn(NO3)2) – соединение, содержащее ионы цинка и нитрата. Он растворим в воде и широко используется в промышленности для различных целей, в том числе в качестве катализатора и при производстве красителей и пигментов.
| Название ИЮПАК | Нитрат цинка |
| Молекулярная формула | Zn(NO3)2 |
| Количество CAS | 7779-88-6 |
| Синонимы | Цинк динитрат, цинковая соль азотной кислоты, целлоксан, нитрат цинка |
| ИнЧИ | InChI=1S/2NO3.Zn/c2 2-1(3)4;/q2 -1;+2 |
Свойства нитрата цинка
Формула нитрата цинка
Формула динитрата цинка: Zn(NO3)2. Он состоит из одного иона цинка (Zn2+) и двух ионов NO3-, связанных между собой ионными связями. Формула представляет собой соотношение элементов, присутствующих в соединении.
нитрат цинка Молярная масса
Молярную массу динитрата цинка можно рассчитать путем сложения атомных масс составляющих его элементов. Атомная масса цинка (Zn) составляет примерно 65,38 грамма на моль, а атомная масса азота (N) и кислорода (О) в ионах NO3- примерно 14,01 и 16,00 грамма на моль соответственно. Следовательно, молярная масса динитрата цинка составляет примерно 189,38 грамма на моль.
Температура кипения нитрата цинка
Динитрат цинка не имеет определенной температуры кипения, поскольку он разлагается, не достигнув точки кипения. Однако при нагревании он разлагается на оксид цинка, диоксид азота и кислород. Эта реакция разложения происходит при температуре около 140°C (284°F), выделяя коричневые пары диоксида азота.
Температура плавления нитрата цинка
Температура плавления динитрата цинка зависит от его гидратного состояния. Безводная форма динитрата цинка (Zn(NO3)2) плавится примерно при 238°C (460°F). Однако гексагидратная форма (Zn(NO3)2·6H2O) имеет более низкую температуру плавления – около 36°C (97°F), поскольку в своей кристаллической структуре содержит молекулы воды.
Плотность нитрата цинка г/мл
Плотность динитрата цинка варьируется в зависимости от его концентрации и температуры. Однако в стандартных условиях плотность безводной формы составляет примерно 2,065 грамма на миллилитр (г/мл). Плотность гексагидратной формы немного выше из-за присутствия молекул воды.
Нитрат цинка Молекулярный вес
Молекулярную массу динитрата цинка рассчитывают путем сложения атомных масс составляющих его элементов. Как упоминалось ранее, молекулярная масса динитрата цинка составляет примерно 189,38 грамма на моль.
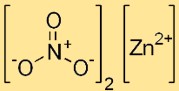
Структура нитрата цинка
Динитрат цинка имеет ионную структуру: катион цинка (Zn2+) окружен шестью молекулами воды в форме гексагидрата. Нитрат-ионы (NO3-) присутствуют в кристаллической решетке в виде дискретных образований.
Растворимость нитрата цинка
Динитрат цинка хорошо растворим в воде. Растворимость увеличивается с температурой. При комнатной температуре примерно 118 грамм динитрата цинка растворяется в 100 граммах воды, образуя насыщенный раствор.
| Появление | Бесцветные кристаллы |
| Удельный вес | 2065 г/мл |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Молярная масса | 189,38 г/моль |
| Плотность | 2065 г/мл |
| Точка плавления | 238°C (460°F) (безводный) |
| Точка кипения | Разлагается (~ 140°C/284°F) |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим в воде |
| Растворимость | Растворим в воде |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | Непригодный |
| рН | ~4 (водный раствор) |
Безопасность и вред нитрата цинка
Динитрат цинка представляет некоторые риски для безопасности, которые необходимо учитывать. Важно обращаться с ним осторожно, чтобы предотвратить возможные риски. Контакт с соединением может вызвать раздражение кожи и глаз. Проглатывание или вдыхание динитрата цинка может вызвать расстройство желудочно-кишечного тракта и респираторную недостаточность. При работе с динитратом цинка рекомендуется использовать соответствующие защитные меры, такие как перчатки и очки. Кроме того, его следует хранить в хорошо проветриваемом помещении, вдали от несовместимых веществ. В случае случайного воздействия или проглатывания рекомендуется обратиться к врачу. Соблюдение надлежащих протоколов безопасности обеспечивает безопасное обращение и использование динитрата цинка.
| Символы опасности | Окислитель |
| Описание безопасности | Вызывает раздражение кожи и глаз. Избегайте проглатывания и вдыхания. Обращаться с соответствующими мерами защиты. |
| Идентификационные номера ООН | № ООН 1514 (безводный), № ООН 1515 (гексагидрат) |
| код ТН ВЭД | 28342990 |
| Класс опасности | 5.1 (Окисляющие вещества) |
| Группа упаковки | II (безводный), III (гексагидрат) |
| Токсичность | Умеренно токсичный |
Методы синтеза нитрата цинка
Существуют различные методы синтеза динитрата цинка. Распространенным подходом является реакция между металлическим цинком и азотной кислотой . В этом методе цинк реагирует с азотной кислотой с образованием динитрата цинка и выделением газообразного водорода. Операторы тщательно контролируют реакцию для обеспечения безопасности.
Другой метод включает реакцию между оксидом цинка и азотной кислотой . Оксид цинка растворяется в азотной кислоте, что приводит к образованию динитрата цинка и воды. Этот метод полезен, когда оксид цинка легко доступен.
Кроме того, карбонат цинка может реагировать с азотной кислотой с образованием динитрата цинка. Карбонат реагирует с азотной кислотой, образуя углекислый газ, воду и динитрат цинка.
Важно отметить, что эти реакции необходимо проводить в соответствующих лабораторных условиях с соблюдением необходимых мер предосторожности. Следует носить соответствующее защитное оборудование, такое как перчатки и очки, а реакции следует проводить в хорошо проветриваемом помещении.
В целом эти методы обеспечивают эффективные способы синтеза динитрата цинка, что позволяет использовать его в различных промышленных целях.
Использование нитрата цинка
Динитрат цинка находит применение в различных отраслях промышленности благодаря своим универсальным свойствам. Вот некоторые ключевые области применения динитрата цинка:
- Катализатор: Динитрат цинка катализирует различные химические реакции, облегчая производство красителей, фармацевтических препаратов и полимеров.
- Гальваника: В процессах гальваники динитрат цинка наносит слой цинка на металлические поверхности, придавая коррозионную стойкость и улучшая внешний вид.
- Пигменты и красители. Динитрат цинка выступает в качестве прекурсора при производстве пигментов и красителей на основе цинка, необходимых для красок, покрытий и текстиля.
- Удобрение: Динитрат цинка служит источником цинка в удобрениях, обеспечивая получение растениями достаточного количества питательных веществ для роста и развития.
- Производство стекла: Динитрат цинка играет важную роль в производстве стекла, улучшая оптические свойства, такие как прозрачность и показатель преломления.
- Очистка воды: динитрат цинка играет важную роль в системах очистки воды, контролируя рост водорослей и бактерий и поддерживая качество воды.
- Лабораторный реагент: В различных лабораторных экспериментах динитрат цинка активно действует как реагент, особенно в аналитической химии и исследованиях.
- Медицина и фармацевтика: динитрат цинка активно участвует в некоторых фармацевтических препаратах и препаратах местного применения благодаря своим противомикробным свойствам.
- Антипирены: динитрат цинка является ключевым компонентом антипиреновых составов, активно снижая воспламеняемость материалов.
- Текстильная промышленность: в процессах крашения и печати тканей динитрат цинка активно повышает стойкость цвета и улучшает впитывание красителей.
Эти разнообразные применения подчеркивают важность динитрата цинка во многих отраслях промышленности, внося свой вклад в широкий спектр продуктов и процессов.
Вопросы:
Вопрос: Растворим ли нитрат цинка?
Ответ: Да, динитрат цинка растворим в воде.
Вопрос: Как осадить карбонат цинка из нитрата цинка?
A: Чтобы осадить карбонат цинка из Zn(NO3)2, добавьте раствор карбоната натрия или бикарбоната натрия к раствору динитрата цинка, что приведет к образованию карбоната цинка в виде осадка.
Вопрос: Реагирует ли цинк с нитратом серебра?
Ответ: Да, Zn реагирует с нитратом серебра, вытесняя металлическое серебро и образуя динитрат цинка.
Вопрос: Является ли нитрат цинка солью?
Ответ: Да, нитрат цинка представляет собой соль, состоящую из катионов цинка (Zn2+) и ионов NO3-.
Вопрос: Что образуется при реакции нитрата цинка с гидроксидом калия?
Ответ: Когда Zn(NO3)2 реагирует с гидроксидом калия, Zn(OH)2 выпадает в осадок и образуется нитрат калия.
Вопрос: Какова формула нитрата лития-цинка?
A: Формула динитрата лития-цинка: LiZn(NO3)3.
Вопрос: Как стандартизировать раствор нитрата магния и нитрата цинка?
Ответ: Для стандартизации растворов нитрата магния и динитрата Zn можно использовать методы титрования с использованием соответствующего стандартизированного реагента.
Вопрос: Какие кислоты и оксиды металлов используются для производства нитрата цинка?
Ответ: Азотная кислота (HNO3) и оксид цинка (ZnO) используются для производства динитрата цинка.
Вопрос: Какие продукты получаются, когда цинк добавляется в раствор нитрата свинца?
Ответ: При добавлении Zn к раствору нитрата свинца образуются динитрат цинка и металлический свинец.
Вопрос: Что такое нитрат цинка?
Ответ: Динитрат цинка представляет собой химическое соединение, состоящее из катионов цинка (Zn2+) и анионов NO3-, часто встречающееся в виде твердого кристаллического вещества.
Вопрос: Сколько атомов кислорода содержится в 1,50 молях Zn(NO3)2?
Ответ: В 1,50 молях Zn(NO3)2 содержится 9,00 молей или 27,00 атомов кислорода.
Вопрос: Какую массу Zn(NO3)2 следует разбавить H2O до массы 1,00 кг, чтобы получить 97 ppm Zn2+(водн.)?
Ответ: Для приготовления раствора, содержащего 97 ppm Zn2+(водн.), примерно 97 мг Zn(NO3)2 необходимо разбавить водой до массы 1,00 кг.
