Нитрат магния представляет собой белое кристаллическое соединение с химической формулой Mg(NO3)2. Его используют в производстве удобрений, взрывчатых веществ и пиротехнических изделий благодаря высокой реакционной способности и окислительным свойствам.
| Название ИЮПАК | Динитрат магния |
| Молекулярная формула | Мг(NO3)2 |
| Количество CAS | 10377-60-3 |
| Синонимы | Азотная кислота, магниевая соль; ООН 1474; Нитрат магния (II); Магниевая соль азотной кислоты (2+) |
| ИнЧИ | InChI=1S/Mg.2NO3/c;22-1(3)4/q+2;2-1 |
Формула нитрата магния
Химическая формула нитрата магния — Mg(NO3)2, что указывает на то, что соединение содержит один катион магния (Mg²⁺) и два нитрат-аниона (NO₃⁻). Эта формула используется для представления стехиометрии соединения в химических уравнениях, а также для определения молекулярной массы и других свойств нитрата магния.
Молярная масса of нитрат магния
Молярная масса нитрата магния, представленная химической формулой Mg(NO3)2, составляет примерно 148,31 г/моль. Это значение можно рассчитать, сложив атомные массы магния (24,31 г/моль), двух атомов азота (28,02 г/моль каждый) и шести атомов кислорода (16,00 г/моль каждый), присутствующих в соединении. Знание молярной массы имеет решающее значение для определения количества нитрата магния, необходимого для химических реакций или приготовления растворов.
Температура кипения нитрата магния
Mg(NO3)2 имеет относительно высокую температуру кипения около 330°C (626°F) при атмосферном давлении. Это значение может незначительно меняться в зависимости от чистоты и концентрации соединения. Температура кипения Mg(NO3)2 важна в промышленных процессах производства удобрений, взрывчатых веществ и пиротехники, а также в лабораторных экспериментах.
Температура плавления нитрата магния
Температура плавления Mg(NO3)2, то есть температура, при которой твердое соединение переходит в жидкое состояние, составляет примерно 89°C (192°F) для безводной формы и 95°C (203°F) для безводная форма. гексагидратная форма. Гексагидратная форма Mg(NO3)2 чаще используется из-за ее стабильности и простоты обращения. Температура плавления является важным физическим свойством, используемым для определения чистоты Mg(NO3)2, а также в различных промышленных процессах.
Плотность нитрата магния г/мл
Плотность Mg(NO3)2 варьируется в зависимости от формы соединения. Безводная форма имеет плотность примерно 2,3 г/см³, а гексагидратная форма имеет плотность примерно 1,46 г/см³. Плотность Mg(NO3)2 является решающим фактором при определении объема соединения, необходимого в химических реакциях, а также при его хранении и транспортировке.
Молекулярный вес нитрата магния
Молекулярная масса Mg(NO3)2, представляющая собой сумму атомных масс всех элементов соединения, составляет примерно 148,31 г/моль. Эта величина важна при различных химических расчетах, в частности для определения количества Mg(NO3)2, необходимого в реакциях или при приготовлении растворов.
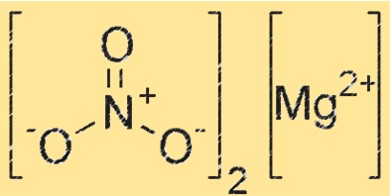
Структура нитрата магния
Mg(NO3)2 имеет кристаллическую структуру, принадлежащую ромбической кристаллической системе. Соединение состоит из катионов магния (Mg²⁺) и нитрат-анионов (NO₃⁻), причем каждый катион магния окружен шестью нитрат-анионами в октаэдрическом расположении. Кристаллическая структура Mg(NO3)2 играет решающую роль в его реакционной способности и свойствах.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 2,3 (безводный), 1,46 (гексагидрат) |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 148,31 г/моль |
| Плотность | 2,3 г/см³ (безводный), 1,46 г/см³ (гексагидрат) |
| Точка плавления | 89°С (безводный), 95°С (гексагидрат) |
| Точка кипения | 330°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | 234 г/л (безводный), 156 г/л (гексагидрат) при 20°C |
| Растворимость | Растворим в воде, этаноле, метаноле. |
| Давление газа | 0,000009 мм рт.ст. при 20°C |
| Плотность пара | Непригодный |
| пКа | 1,8 |
| рН | 4,5-6,0 (5% раствор) |
Безопасность и вред нитрата магния
Mg(NO3)2 может представлять различные риски для безопасности при неправильном обращении. При контакте или вдыхании может вызвать раздражение и ожоги кожи, глаз и дыхательных путей. Соединение также является сильным окислителем и может бурно реагировать с органическими материалами, включая легковоспламеняющиеся и горючие вещества. Вдыхание пыли Mg(NO3)2 может вызвать раздражение дыхательных путей и даже повреждение легких. Храните и обращайтесь с Mg(NO3)2 в прохладном, сухом, хорошо проветриваемом помещении, вдали от источников возгорания. При работе с этим соединением используйте соответствующие средства индивидуальной защиты, такие как перчатки и защитные очки.
| Символы опасности | Окислитель |
| Описание безопасности | Избегайте контакта с горючими материалами. Носите средства индивидуальной защиты. Хранить вдали от источников возгорания. |
| Идентификаторы сети | ООН 1474 |
| код ТН ВЭД | 283429 |
| Класс опасности | 5.1 (Окислители) |
| Группа упаковки | II |
| Токсичность | LD50 (перорально, крыса): 3500 мг/кг; LD50 (кожный, кролик): > 2000 мг/кг. Нитрат магния не считается канцерогенным, мутагенным или тератогенным. |
Методы синтеза нитрата магния
Нитрат магния (Mg(NO3)2) можно синтезировать несколькими методами, в том числе реакцией оксида или гидроксида магния с азотной кислотой.
Один из методов включает добавление оксида магния к раствору азотной кислоты в колбе, а затем осторожное нагревание смеси до ее растворения. Для получения кристаллов Mg(NO3)2 раствор фильтруют от примесей и выпаривают растворитель.
Другой метод синтеза включает взаимодействие металлического магния с азотной кислотой . Добавьте полоски магния в кислоту и дайте реакции продолжаться до тех пор, пока весь металл не растворится. Затем выпарите полученный раствор, чтобы получить кристаллы Mg(NO3)2.
Растворите карбонат магния в азотной кислоте с образованием Mg(NO3)2 и углекислого газа. Полученный раствор профильтровать и выпарить до получения кристаллов Mg(NO3)2.
Другой метод — реакция гидроксида магния с азотной кислотой с образованием Mg(NO3)2 и воды. Полученный раствор затем очищают фильтрованием и выпариванием с получением кристаллов Mg(NO3)2.
Использование нитрата магния
Нитрат магния имеет множество применений в различных отраслях промышленности и применениях. Некоторые из основных применений Mg(NO3)2:
- Сельское хозяйство: используется в качестве удобрения, особенно для культур, требующих высокого уровня магния, таких как помидоры, перец и цитрусовые. Это помогает улучшить рост растений и улучшить качество урожая и урожайность.
- Пиротехнические изделия: используются в качестве окислителя в фейерверках и других пиротехнических устройствах, поскольку они могут создавать яркое, интенсивное пламя и помогают контролировать скорость горения.
- Производство стекла: используется в качестве флюса при производстве стекла для снижения температуры плавления стекла и улучшения его текучести.
- Химический синтез: используется в качестве реагента в различных реакциях химического синтеза, таких как производство других соединений магния, катализаторов и фармацевтических препаратов.
- Консервация: используется в качестве пищевого консерванта для подавления роста бактерий и других микроорганизмов.
- Промышленное применение: Используется при производстве оксида и гидроксида магния, которые используются в качестве антипиренов, при очистке сточных вод и в качестве нейтрализующего агента в кислых почвах.
- Лабораторные исследования: используется в различных лабораторных экспериментах и исследованиях, таких как приготовление стандартных растворов и тестирование аналитических процедур.
Вопросы:
Вопрос: Растворим ли Mg(NO3)2?
Ответ: Да, нитрат магния хорошо растворим в воде.
Вопрос: Какова формула нитрата магния?
Ответ: Формула нитрата магния: Mg(NO3)2.
Вопрос: Какова молярная масса Mg(NO3)2?
A: Молярная масса Mg(NO3)2 составляет 148,31 г/моль.
Вопрос: Какова формульная масса Mg(NO3)2?
A: Формульная масса Mg(NO3)2 составляет 148,31 г/моль.
Вопрос: Каково систематическое название Mg(NO3)2?
Ответ: Систематическое название Mg(NO3)2 — динитрат магния.
Вопрос: Какова концентрация нитрат-ионов в растворе 0,125 М Mg(NO3)2?
Ответ: Концентрация нитрат-ионов в растворе 0,125 М Mg(NO3)2 равна 0,25 М, поскольку на каждый ион магния приходится два нитрат-иона.
Вопрос: Какова формула массы Mg(NO3)2?
A: Формульная масса Mg(NO3)2 составляет 148,31 г/моль.
