Нитрат калия (KNO3) представляет собой белую кристаллическую соль, часто используемую в удобрениях, консервировании пищевых продуктов и фейерверках. Он также является ключевым ингредиентом некоторых зубных паст для чувствительных зубов.
| Название ИЮПАК | Азотнокислый калий |
| Молекулярная формула | КНО3 |
| Количество CAS | 7757-79-1 |
| Синонимы | селитра; нитрат калия; селитра; селитра; Е252; китайская селитра; азотная кислота, калийная соль; Нитры Калии |
| ИнЧИ | ИнХI=1S/K.NO3/c;2-1(3)4/q+1;-1 |
Свойства калиевой селитры
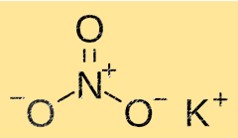
Формула нитрата калия
Химическая формула нитрата калия — KNO3. Эта формула показывает, что соединение состоит из одного иона калия, одного нитрат-иона и трех ионов кислорода. Формула полезна для расчета количества нитрата калия, необходимого для реакции, а также для определения элементов и ионов, присутствующих в соединении.
нитрат калия Молярная масса
KNO3 имеет молярную массу 101,1 г/моль. Молярная масса — это масса одного моля вещества, которая рассчитывается путем сложения атомных масс всех атомов соединения. В случае KNO3 молярная масса рассчитывается путем сложения атомных масс одного атома калия, одного атома азота и трех атомов кислорода. Это значение полезно для определения количества KNO3, необходимого для реакции, а также для расчета других свойств, таких как концентрация.
Температура кипения нитрата калия
KNO3 имеет относительно высокую температуру кипения — 1,336 °C (2,437 °F). Это означает, что требуется много энергии, чтобы разорвать связи между атомами соединения и превратить его из жидкости в газ. Это свойство делает KNO3 полезным в приложениях, требующих высокотемпературных реакций, например, при производстве фейерверков.
Температура плавления нитрата калия
KNO3 имеет температуру плавления 334°C (633°F). Это означает, что при температуре выше 334°C KNO3 переходит из твердого состояния в жидкость. Это свойство делает KNO3 полезным в таких областях, как производство стекла, где он используется в качестве флюса для снижения температуры плавления кремнезема.
Плотность нитрата калия г/мл
Плотность KNO3 составляет 2,109 г/мл при комнатной температуре. Плотность – это мера массы единицы объема вещества. Плотность KNO3 важна в таких областях, как производство удобрений, где он используется в качестве источника азота и калия. Плотность также полезна для определения количества KNO3, необходимого в данном объеме раствора.
Нитрат калия Молекулярный вес
Молекулярная масса KNO3 составляет 101,1 г/моль. Это значение рассчитывается путем сложения атомных весов всех атомов соединения. Молекулярный вес полезен для расчета других свойств KNO3, таких как количество KNO3, необходимое для реакции, или концентрация раствора.
Структура нитрата калия
KNO3 имеет кристаллическую структуру, состоящую из ионов калия, нитрата и кислорода. Ионы калия окружены шестью ионами нитрата, а ионы нитрата окружены шестью ионами калия. Эта структура придает KNO3 его характерные свойства, такие как растворимость, температура плавления и плотность.
| Появление | Белый кристаллический порошок |
| Удельный вес | 2,109 г/см³ при 20°C |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 101,1032 г/моль |
| Плотность | 2,109 г/см³ |
| Точка плавления | 334°С (633°Ф) |
| Точка кипения | 400°С (752°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | 133 г/л при 20°C |
| Растворимость | Растворим в глицерине, аммиаке и воде. |
| Давление газа | Незначительный |
| Плотность пара | Непригодный |
| пКа | 4,75 |
| рН | 6,9 – 7,3 |
Безопасность и вред нитрата калия
KNO3 относительно безопасен при правильном обращении, но может представлять опасность при неправильном обращении. Он классифицируется как окислитель, что означает, что он может способствовать горению других материалов. KNO3 также может раздражать глаза, кожу и дыхательные пути и может быть токсичным при проглатывании или вдыхании в больших количествах. При работе с KNO3 важно носить защитное оборудование, такое как перчатки, очки и респиратор, и хранить его в сухом прохладном месте вдали от легковоспламеняющихся материалов. Также следует соблюдать надлежащие методы утилизации, чтобы избежать загрязнения окружающей среды.
| Символы опасности | О, Хн |
| Описание безопасности | Храните вдали от источников тепла/искры/открытого огня/горячих поверхностей. Надевайте защитные перчатки/защиту глаз/лица. ПРИ ПРОГЛАТЫВАНИИ: Если вы плохо себя чувствуете, позвоните в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР/к врачу. Прополощите рот. Не вызывает рвоту. ПРИ ВДЫХАНИИ: Вынесите пострадавшего на свежий воздух и обеспечьте покой в удобном для дыхания положении. Позвоните в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР/врачу. |
| Идентификационные номера ООН | 1486 |
| код ТН ВЭД | 2834.21.00 |
| Класс опасности | 5.1 |
| Группа упаковки | III |
| Токсичность | При вдыхании может вызвать раздражение дыхательных путей, кашель и одышку. Может вызвать раздражение глаз и кожи. Проглатывание может вызвать боль в животе, тошноту, рвоту и диарею. Может быть токсичным при проглатывании или вдыхании в больших количествах. |
Методы синтеза нитрата калия
Несколько методов позволяют синтезировать KNO3.
Распространенным методом является реакция между гидроксидом калия и азотной кислотой . В реакционном сосуде смешиваются два вещества и нагреваются до высокой температуры, обычно около 80°C. После этого смесь охлаждается и в процессе фильтрации выделяется твердый KNO3.
Другой метод — реакция хлорида калия и нитрата натрия. Человек смешивает два вещества в реакционном сосуде и нагревает их до высокой температуры, обычно около 600°C.
Полученная смесь плавится, а затем затвердевает, образуя кристаллы KNO3.
Третий метод предполагает окисление аммиака азотной кислотой в присутствии катализатора. Этот метод более сложен и обычно используется в промышленных масштабах.
KNO3 можно извлечь из природных источников, таких как пещеры и подземные месторождения. Однако этот метод менее распространен из-за низких выходов и присутствия примесей в экстрагируемом KNO3.
Использование нитрата калия
KNO3 имеет широкий спектр применения в различных отраслях промышленности благодаря своим химическим свойствам. Вот некоторые распространенные варианты использования KNO3:
- Удобрение – используется в качестве удобрения из-за высокого содержания азота и калия. Это особенно полезно для культур, которым требуется высокий уровень калия, таких как фрукты, овощи и табак.
- Консервация пищевых продуктов. Также используется в качестве консерванта пищевых продуктов, особенно в колбасных изделиях. Он подавляет рост бактерий и предотвращает порчу, тем самым продлевая срок хранения продукта.
- Пиротехника – это ключевой элемент при изготовлении фейерверков и других пиротехнических устройств. Он действует как окислитель, производя кислород для горения других материалов.
- Зубная паста – добавляется в некоторые зубные пасты для снижения чувствительности зубов. Он работает, блокируя передачу болевых сигналов от зубного нерва в мозг.
- Лекарственное использование – используется в медицине из-за его мочегонных и отхаркивающих свойств. Он также лечит стенокардию и гипертонию.
- Промышленное применение – также используется в различных отраслях промышленности, таких как производство стекла, керамики и красителей.
Вопросы:
Вопрос: Растворяется ли нитрат калия в воде?
О: Да, KNO3 хорошо растворим в воде. При комнатной температуре в 100 граммах воды растворяется примерно 37 граммов KNO3.
Вопрос: Для чего используется нитрат калия?
Ответ: KNO3 используется для различных целей, в том числе в качестве удобрения, пищевого консерванта, пиротехнического окислителя, ингредиента зубной пасты, а также в качестве компонента при производстве стекла, керамики и красителей.
Вопрос: Что такое нитрат калия?
Ответ: Нитрат калия, также известный как селитра, представляет собой химическое соединение с формулой KNO3. Это ионная соль, состоящая из ионов калия (K+) и ионов нитрата (NO3-).
Вопрос: Что нейтрализует нитрат калия?
Ответ: Ионы кальция и магния могут противодействовать вредному воздействию избыточного количества KNO3 на растения. У людей не существует известного противоядия от отравления KNO3, и лечение очень полезно.
Вопрос: Растворим ли kno3 в воде?
О: Да, KNO3 хорошо растворим в воде.
Вопрос: Что представляет собой продукт электролиза воды, содержащий низкую концентрацию kno3?
Ответ: Продуктами электролиза воды, содержащими низкую концентрацию KNO3, являются газообразный водород (H2) и газообразный кислород (O2).
Вопрос: Что такое но3?
Ответ: KNO3 — это химическая формула нитрата калия, также известного как селитра.
Вопрос: Какова степень окисления отдельного атома азота в kno3?
Ответ: В KNO3 степень окисления каждого атома азота равна +5.
Вопрос: Kno3 – это кислота или основание?
Ответ: KNO3 не является ни кислотой, ни основанием. Это соль, состоящая из катиона (K+) и аниона (NO3-).
