Нитрит натрия (NaNO2) — это химическое соединение, обычно используемое в качестве пищевого консерванта для предотвращения роста бактерий и улучшения цвета и вкуса колбасных изделий, таких как бекон и хот-доги.
| Название ИЮПАК | Нитрат натрия |
| Молекулярная формула | NaNO2 |
| Количество CAS | 7632-00-0 |
| Синонимы | Азотистая кислота, натриевая соль; Е250; натрийнитрит; Нитрат натрия; нитрито натрия; ООН 1500 |
| ИнЧИ | InChI=1S/NO2.Na/c2-1-3;/q-1;+1 |
Свойства нитрита натрия
Формула нитрита натрия
Химическая формула нитрита натрия – NaNO2. Это указывает на то, что в одном моле нитрита натрия содержится один катион натрия, один атом азота и два атома кислорода. Формула используется для представления состава вещества и может использоваться для прогнозирования реакций, которым может подвергаться вещество.
Нитрит натрия Молярная масса
NaNo2 имеет молярную массу 69,0 г/моль. Это масса одного моля NaNo2, равная количеству вещества, содержащего 6,02 х 10^23 отдельных молекул соединения. Молярная масса — это важное физическое свойство, используемое для расчета различных химических и физических свойств вещества.
Температура кипения нитрита натрия
Температура кипения NaNo2 составляет 320°C (608°F). Это температура, при которой NaNo2 переходит из жидкого состояния в газообразное. Температура кипения является важным свойством, поскольку она может влиять на то, как вещество используется в различных промышленных целях, таких как производство красителей, пигментов и фармацевтических препаратов.
Нитрит натрия Температура плавления
Температура плавления NaNo2 составляет 271°C (520°F). Это температура, при которой NaNo2 переходит из твердого состояния в жидкость. Температура плавления является важным свойством, поскольку она может влиять на стабильность и реакционную способность вещества при разных температурах.
Плотность нитрита натрия г/мл
Плотность NaNo2 составляет 2,168 г/мл. Плотность представляет собой массу единицы объема вещества и может использоваться для определения концентрации раствора. Плотность NaNo2 также можно использовать для определения чистоты образца.
Нитрит натрия Молекулярный вес
Молекулярная масса NaNo2 составляет 69,0 г/моль. Это сумма атомных весов всех атомов в молекуле соединения. Молекулярный вес — важное свойство, используемое для расчета различных химических и физических свойств вещества.
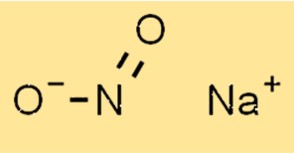
Структура нитрита натрия
Структура NaNo2 состоит из катиона натрия (Na+) и нитрит-аниона (NO2-). Нитрит-анион имеет тригональную плоскую геометрию с одним атомом азота и двумя атомами кислорода. Катион натрия расположен в центре нитрит-аниона.
Растворимость нитрита натрия
NaNo2 растворим в воде, его растворимость составляет 820 г/л при 20°C. Растворимость – это максимальное количество вещества, которое можно растворить в данном количестве растворителя при данной температуре. На растворимость NaNo2 могут влиять такие факторы, как температура и присутствие других растворенных веществ.
| Появление | Кристаллический порошок от белого до слегка желтоватого цвета. |
| Удельный вес | 2168 г/мл |
| Цвет | От белого до слегка желтоватого |
| Запах | Без запаха |
| Молярная масса | 69,0 г/моль |
| Плотность | 2168 г/мл |
| Точка плавления | 271°С (520°Ф) |
| Точка кипения | 320°С (608°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | 820 г/л при 20°C |
| Растворимость | Растворим в этаноле и глицерине. |
| Давление газа | 1,33 кПа при 20°C |
| Плотность пара | 2,3 (воздух = 1) |
| пКа | 3.34 |
| рН | 7-8 (10% раствор) |
Безопасность и опасность нитрита натрия
NaNo2 может представлять ряд опасностей для здоровья человека и окружающей среды. Он считается токсичным при проглатывании, вдыхании или проникновении через кожу и может вызвать метгемоглобинемию — состояние, при котором кровь не может переносить кислород к тканям организма. NaNo2 также может вызывать раздражение глаз, кожи и дыхательных путей. Важно обращаться с NaNo2 осторожно, используя соответствующие средства индивидуальной защиты и соблюдая надлежащие процедуры обращения и утилизации. Кроме того, NaNo2 может представлять опасность для окружающей среды, если его неправильно хранить и утилизировать.
| Символы опасности | Т+,С |
| Описание безопасности | Хранить вдали от горючих материалов. Не вдыхать пыль/дым/газ/туман/пары/спрей. Надевайте защитные перчатки/одежду и средства защиты глаз/лица. В случае пожара: Для тушения используйте CO2, химический порошок или пену. Утилизируйте содержимое/контейнер в соответствии с местными/региональными/национальными/международными правилами. |
| Идентификационные номера ООН | ООН1500 |
| код ТН ВЭД | 283410 |
| Класс опасности | 5.1 |
| Группа упаковки | II |
| Токсичность | Очень токсичен при проглатывании, вдыхании и попадании через кожу. Может вызвать метгемоглобинемию. Раздражает глаза, кожу и дыхательную систему. |
Методы синтеза нитрита натрия
Существует несколько методов синтеза NaNo2.
Распространенным методом является взаимодействие азотной кислоты и гидроксида натрия с образованием нитрата натрия. Восстановитель, такой как железо или цинк, восстанавливает нитрат натрия с образованием NaNo2.
Другой метод включает реакцию нитрата натрия с соляной кислотой , в результате которой образуется смесь азотной кислоты и хлорида натрия. Гидроксид натрия реагирует с азотной кислотой с образованием NaNo2.
Синтез NaNo2 может происходить посредством реакции между аммиаком и нитратом натрия , в результате которой в качестве продуктов образуются NaNo2 и вода.
В процессе производства азотной кислоты в качестве побочного продукта образуется NaNo2 при окислении аммиака.
Применение нитрита натрия
NaNo2 находит различное применение в различных отраслях промышленности, в том числе:
- Консервация пищевых продуктов: обычно используется в качестве консерванта для пищевых продуктов, особенно в колбасных изделиях, таких как бекон и хот-доги. Это помогает предотвратить рост вредных бактерий и сохраняет цвет и вкус мяса.
- Промышленное применение: используется в различных отраслях промышленности, таких как обработка металлов и в качестве ингибитора коррозии. Также используется в производстве красителей и других химикатов.
- Медицинское применение: используется в медицине для лечения отравления цианидами, поскольку он превращает гемоглобин в метгемоглобин, который может связываться с ионами цианида и предотвращать их связывание с гемоглобином.
- Очистка воды: используется при очистке воды для контроля роста вредных бактерий и водорослей в водных системах.
- Сельское хозяйство: используется в сельском хозяйстве в качестве удобрения, помогая повысить урожайность и качество сельскохозяйственных культур.
- Фотография: используется в фотографии в качестве проявляющего агента.
Вопросы:
Вопрос: Что такое нитрит натрия?
Ответ: NaNo2 — химическое соединение формулы NaNO2. Это белый или слегка желтоватый кристаллический порошок, обычно используемый в качестве пищевого консерванта и в различных промышленных целях.
Вопрос: Кто открыл нитрит натрия?
Ответ: NaNO2 был впервые открыт в 1805 году французским химиком Луи Николя Вокленом.
Вопрос: Вреден ли для вас нитрит натрия?
Ответ: Чрезмерное потребление NaNo2 может нанести вред здоровью человека. Это связано с такими проблемами со здоровьем, как рак и метгемоглобинемия — заболевание, при котором кровь не может эффективно переносить кислород. Однако при использовании в регулируемых и ограниченных количествах NaNo2 считается безопасным для потребления.
Вопрос: Какова формула нитрита натрия?
Ответ: Формула нитрита натрия — NaNO2.
Вопрос: Безопасен ли нитрит натрия?
Ответ: NaNo2 обычно считается безопасным для потребления при использовании в регулируемых и ограниченных количествах. Однако чрезмерное употребление может нанести вред здоровью человека.
Вопрос: Как сделать нитрит натрия?
Ответ: NaNo2 можно синтезировать различными методами, такими как реакция азотной кислоты и гидроксида натрия, реакция нитрата натрия с соляной кислотой и реакция аммиака с нитратом натрия. Однако синтез NaNo2 необходимо проводить с осторожностью, так как он предполагает использование опасных химических веществ и требует принятия соответствующих мер безопасности.
Вопрос: Является ли нитрит натрия окислителем?
Ответ: Да, NaNo2 является окислителем. Его широко используют в пиротехнике в качестве окислителя.
В: Как нитрит натрия влияет на цвет мяса?
Ответ: NaNO2 обычно используется в качестве пищевого консерванта в колбасных изделиях, таких как бекон и хот-доги. Он помогает сохранить цвет мяса, подавляя рост вредных бактерий, которые могут вызвать изменение цвета.
Вопрос: Как NaNO2 и NaNO3 производятся в промышленных масштабах?
Ответ: NaNO3 и NaNO2 производятся в промышленных масштабах различными методами, такими как окисление аммиака и реакция гидроксида натрия с азотной кислотой. Они используются в различных промышленных, медицинских и сельскохозяйственных целях, а также для консервирования пищевых продуктов.
