Карбонат магния (MgCO3) представляет собой белое порошкообразное вещество, обычно используемое в качестве антацидного и слабительного средства. Он также содержится в некоторых косметических средствах и зубных пастах. Карбонат магния помогает нейтрализовать избыток желудочной кислоты и облегчить запор.
| Название ИЮПАК | Карбонат магния |
| Молекулярная формула | MgCO3 |
| Количество CAS | 546-93-0 |
| Синонимы | Магнезит, Magnesia Carbonica, магниевая соль (MgCO3) |
| ИнЧИ | InChI=1S/CH2O3.Mg/c2-1(3)4;/h(H2,2,3,4);/q;+2 |
Свойства карбоната магния
Формула карбоната магния
Химическая формула карбоната магния – MgCO3. Эта формула указывает на то, что карбонат магния содержит один ион Mg+2 и один ион CO32-. Ион CO3 2 состоит из одного атома C и трех атомов O. Химическая формула карбоната магния является важным свойством, поскольку она определяет состав карбоната магния и входящих в его состав элементов.
карбонат магния Молярная масса
Молярная масса MgCO3 составляет 84,31 г/моль. Это значение получается сложением атомных масс атомов магния, углерода и кислорода в одном моле MgCO3. Молярная масса является важным физическим свойством MgCO3, поскольку она используется в различных расчетах, таких как определение количества молей MgCO3 в данном образце.
Температура кипения карбоната магния
MgCO3 не имеет определенной температуры кипения, поскольку он разлагается до достижения точки кипения. При нагревании MgCO3 разлагается с образованием оксида магния и углекислого газа. Разложение MgCO3 происходит при температуре около 350°С.
Карбонат магния Температура плавления
Температура плавления MgCO3 составляет 990°С. При этой температуре MgCO3 плавится и разлагается с образованием оксида магния и углекислого газа. Температура плавления MgCO3 является важным физическим свойством, поскольку она определяет температуру, при которой MgCO3 можно плавить и перерабатывать.
Плотность карбоната магния г/мл
Плотность MgCO3 составляет 2,958 г/мл. Это значение получается путем деления массы одного моля MgCO3 на его объем. Плотность MgCO3 является важным физическим свойством, поскольку она используется в различных приложениях, таких как определение плавучести MgCO3 в данном растворе.
Молекулярный вес карбоната магния
Молекулярная масса MgCO3 составляет 84,31 г/моль. Это значение получается сложением атомных масс атомов магния, углерода и кислорода в молекуле MgCO3. Молекулярная масса MgCO3 является важным физическим свойством, поскольку она используется в различных расчетах, например, при определении количества MgCO3, необходимого для данной химической реакции.
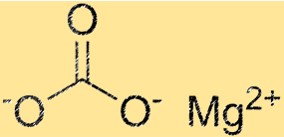
Структура карбоната магния
MgCO3 имеет тригональную кристаллическую структуру. Ион магния расположен в центре структуры и окружен шестью карбонат-ионами. Ионы карбоната расположены шестиугольно вокруг иона магния. Кристаллическая структура MgCO3 является важным свойством, поскольку определяет его физические и химические свойства.
| Появление | Белый твердый |
| Удельная плотность | 2958 г/мл |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 84,31 г/моль |
| Плотность | 2958 г/мл |
| Точка плавления | 990°С |
| Точка кипения | Разлагается до достижения точки кипения |
| Мигающая точка | Непригодный |
| Растворимость в воде | 0,02 г/л (15°С) |
| Растворимость | Растворим в кислотах, нерастворим в воде |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | 10.3 |
| рН | 9,2-10,2 |
Безопасность и опасность карбоната магния
MgCO3 считается безопасным соединением. Он не горюч, взрывоопасен и не токсичен. Однако, как и любое другое химическое соединение, с ним следует обращаться осторожно. Вдыхание пыли MgCO3 может вызвать раздражение дыхательных путей. При работе с MgCO3 рекомендуется носить соответствующие средства индивидуальной защиты, такие как перчатки и защитные очки. MgCO3 следует хранить в прохладном, сухом месте, вдали от источников тепла и возгорания. Пролитый MgCO3 необходимо немедленно убрать и утилизировать надлежащим образом. Важно соблюдать надлежащие меры предосторожности при обращении с MgCO3, чтобы избежать любых потенциальных опасностей.
| Символы опасности | Никто |
| Описание безопасности | Не классифицируется как опасный |
| Идентификационные номера ООН | Непригодный |
| код ТН ВЭД | 2836.60.00 |
| Класс опасности | Не классифицируется как опасный |
| Группа упаковки | Непригодный |
| Токсичность | Низкая токсичность, не считается значительным риском для здоровья при правильном обращении. |
Методы синтеза карбоната магния
Существует несколько методов синтеза MgCO3, включая осаждение и термическое разложение.
Чтобы получить MgCO3 методом осаждения, вы добавляете растворимую соль магния (например, хлорид магния или нитрат магния) к раствору, содержащему растворимый карбонат (например, карбонат натрия или нитрат магния). карбонат аммония). Затем перемешайте полученную смесь и дайте ей настояться. Это приводит к выпадению MgCO3 в осадок из раствора. После этого осадок отфильтровать, промыть и высушить.
Для получения MgCO3 методом термического разложения гидроксид или оксид магния нагревают с введением углекислого газа. Эта реакция приводит к образованию MgCO3 и водяного пара. Следующий шаг — сбор, очистка и сушка MgCO3.
Другой метод синтеза MgCO3 — взаимодействие сульфата магния и карбоната натрия . Вода растворяет два соединения, а затем смешивает их, в результате чего MgCO3 выпадает в осадок из раствора. Затем в процессе собираются, промываются и сушат осадок.
Использование карбоната магния
MgCO3 — универсальное соединение, которое можно использовать в различных отраслях промышленности. Вот некоторые из его применений:
- Пищевая добавка: используется в качестве пищевой добавки из-за ее способности обеспечивать организм необходимым магнием.
- Антацид: используется как антацид для лечения изжоги и расстройства желудка.
- Промышленное применение: используется в ряде промышленных применений, например, при производстве керамики, стекла и цемента.
- Косметика: используется в косметике как набухающий, абсорбирующий и матирующий агент.
- Огнезащитный состав: используется в качестве антипирена в различных областях применения, включая изоляционные материалы, текстиль и пластмассы.
- Фармацевтика: используется при производстве различных фармацевтических продуктов, таких как слабительные и антациды.
- Пищевая промышленность: Используется в качестве пищевой добавки для регулирования кислотности пищевых продуктов и в качестве средства, препятствующего слеживанию.
- Спортивное оборудование: используется в спортивном инвентаре, например, в спортивном меле, для улучшения сцепления и предотвращения скольжения.
Вопросы:
Вопрос: Растворим ли карбонат магния в воде?
Ответ: MgCO3 плохо растворяется в воде. При комнатной температуре в 100 мл воды растворяется всего около 0,02 грамма MgCO3.
Вопрос: Растворим ли MgCO3?
Ответ: MgCO3 имеет низкую растворимость в воде, то есть он плохо растворяется.
Вопрос: Что образуется при реакции уксусной кислоты и MgCO3?
Ответ: При реакции уксусной кислоты и MgCO3 образуются ацетат магния, вода и углекислый газ. Сбалансированное химическое уравнение этой реакции: MgCO3 + 2CH3COOH → Mg(CH3COO)2 + H2O + CO2.
Вопрос: Молярная растворимость MgCO3 составляет 1,8 × 10–4 моль/л. Что такое Ksp для этого соединения?
A: Значение Ksp для MgCO3 с использованием молярной растворимости:
Ksp = [Mg2+][CO32-], где [Mg2+] равна молярной растворимости, а [CO32-] также равна молярной растворимости. Следовательно, Ksp = (1,8 × 10–4 моль/л)2 = 3,24 × 10–9.
Вопрос: Что из перечисленного является продуктом разложения MgCO3?
Ответ: При разложении MgCO3 образуется оксид магния (MgO) и углекислый газ (CO2).
Вопрос: Какое сбалансированное химическое уравнение реакции используется для расчета ΔH°f MgCO3(ов)?
A: Сбалансированное химическое уравнение реакции, используемое для расчета стандартной энтальпии образования (ΔH°f) MgCO3(тв): Mg(тв) + CO2(г) → MgCO3(тв).
