Карбонат аммония ((NH4)2CO3) представляет собой соль. Он образуется при реакции аммиака и углекислого газа. Он имеет множество применений, например, для выпечки и нюхания соли.
| Название ИЮПАК | Карбонат аммония |
| Молекулярная формула | (NH4)2CO3 |
| Количество CAS | 506-87-6 |
| Синонимы | нашатырный спирт, летучая соль, соль орешника, E503 |
| ИнЧИ | InChI=1S/CH2O3.2H3N/c2-1(3)4;;/h(H2,2,3,4);2*1H3 |
Свойства карбоната аммония
Формула карбоната аммония
Химическая формула или молекулярная формула карбоната аммония: (NH4)2CO3 1 . Это соль, состоящая из двух ионов аммония и одного иона карбоната. Чтобы показать заряд ионов, можно написать NH4+ + NH4+ + CO3 2-.
Молярная масса карбоната аммония
Молярная масса (NH4)2CO3 составляет 96,09 г/моль 2 . Чтобы рассчитать молярную массу, нам нужно сложить атомные массы всех атомов в формуле. Атомные массы:
- Азот: 14,01 г/моль
- Водород: 1,01 г/моль
- Углерод: 12,01 г/моль
- Кислород: 16,00 г/моль
Таким образом, молярная масса карбоната аммония равна:
(2 х 14,01) + (8 х 1,01) + 12,01 + (3 х 16,00) = 96,09 г/моль
Температура кипения карбоната аммония
(NH4)2CO3 не имеет точки кипения, поскольку он разлагается до достижения этой температуры. При нагревании он разлагается на аммиак и углекислый газ, который выделяется из твердого вещества. Реакция разложения:
(NH4)2CO3 -> 2NH3 + CO2 + H2O
Температура разложения зависит от влажности и давления окружающей среды, но обычно составляет около 60°C.
Карбонат аммония Температура плавления
(NH4)2CO3 имеет температуру плавления 58°C (136°F; 331 К). Однако он также разлагается при этой температуре и поэтому не образует жидкой фазы. Вместо этого он сублимируется непосредственно из твердого состояния в газ.
Плотность карбоната аммония г/мл
Плотность (NH4)2CO3 составляет 1,50 г/мл. Плотность – это масса единицы объема вещества. Чтобы рассчитать плотность, разделите массу на объем. Например, если у нас 10 г (NH4)2CO3 и он занимает 6,67 мл места, то плотность равна:
10 г/6,67 мл = 1,50 г/мл
Молекулярный вес карбоната аммония
Молекулярная масса (NH4)2CO3 равна его молярной массе, которая составляет 96,09 г/моль. Молекулярный вес и молярная масса часто используются как синонимы, но они имеют несколько разные значения. Молекулярная масса — это масса одной молекулы вещества, а молярная масса — это масса одного моля (6,022 х 10^23 молекул) вещества.
Структура карбоната аммония
Строение (NH4)2CO3 может быть представлено точечной структурой Льюиса или шаростержневой моделью. Точечная структура Льюиса показывает валентные электроны каждого атома и то, как они распределяются или передаются для образования связей. Шариковая модель показывает форму и расположение атомов и связей в трех измерениях.
Вот возможная точечная структура Льюиса для карбоната аммония:
ОООО
|| || ||
ХНХ ХНХ ХЧ
| | |
ХХХ
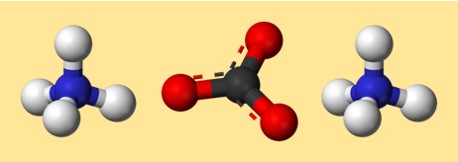
Вот возможная модель карбоната аммония:
В этой модели каждый цвет представляет отдельный элемент:
- Серый: карбон
- Красный: кислород
- Синий: азот
- Белый: водород
Растворимость карбоната аммония
(NH4)2CO3 растворим в воде. Растворимость – это способность вещества растворяться в другом веществе. Когда (NH4)2CO3 растворяется в воде, он образует водные ионы, которые могут взаимодействовать с другими ионами или молекулами в растворе. Реакция растворения:
(NH4)2CO3 + H2O -> 2 NH4+ + CO3 2- + H2O
Растворимость (NH4)2CO3 зависит от температуры и pH воды. При более высоких температурах в воде может раствориться больше (NH4)2CO3.
| Появление | белый порошок |
| Удельная плотность | 1,50 |
| Цвет | Бесцветный |
| Запах | Резкий запах аммиака |
| Молярная масса | 96,09 г/моль |
| Плотность | 1,50 г/мл |
| Точка плавления | 58°С (136°F; 331К) |
| Точка кипения | Разлагается перед кипячением |
| Мигающая точка | Непригодный |
| Растворимость в воде | 100г/100мл (15°С) |
| Растворимость | Растворим в воде, спирте и ацетоне |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | 9,25 (для NH4+) |
| рН | 7,8 (для раствора 0,1М) |
Безопасность и опасность карбоната аммония
(NH4)2CO3 — опасное вещество, которое может вызвать раздражение и повреждение кожи, глаз, носа, горла и легких. Это также может быть вредно при проглатывании. Обращаться с ним следует осторожно и используя средства индивидуальной защиты, такие как перчатки, очки и маски. Его следует хранить в прохладном, сухом, хорошо проветриваемом помещении, вдали от источников тепла, искр и пламени. Его не следует смешивать с сильными кислотами, основаниями или восстановителями, так как он может бурно реагировать или выделять токсичные газы. В случае воздействия немедленно обратитесь за медицинской помощью.
| Символы опасности | Си (раздражает) |
| Описание безопасности | S22: Не дышите пылью. S24/25: Избегать попадания на кожу и в глаза. |
| Идентификационные номера ООН | ООН3077 |
| код ТН ВЭД | 28369910 |
| Класс опасности | 9 |
| Группа упаковки | III |
| Токсичность | Перорально LD50, крыса: 2000 мг/кг. |
Методы синтеза карбоната аммония
(NH4)2CO3 можно синтезировать разными методами в зависимости от исходных материалов и желаемой чистоты продукта. Вот несколько примеров методов синтеза (NH4)2CO3:
- Один метод включает реакцию сульфата аммония с хлоридом аммония и карбонатом кальция в печи. В результате реакции образуются (NH4)2CO3 и хлорид кальция в качестве побочных продуктов. Реакция:
(NH4)2SO4 + 2 NH4Cl + CaCO3 -> 2 (NH4)2CO3 + CaCl2
- Другой метод включает реакцию с диоксидом углерода и аммиаком в водном растворе. В результате реакции образуются (NH4)2CO3 и вода в качестве побочных продуктов. Реакция:
CO2 + 2 NH3 + H2O -> (NH4)2CO3 + H2O
- Третий метод предполагает воздействие на раствор аммония воздуха, содержащего углекислый газ. Бикарбонат аммония является продуктом реакции, и нагревание может привести к его дальнейшему расщеплению до (NH4)2CO3.
Реакции:
NH3 + CO2 + H2O -> NH4HCO3
NH4HCO3 -> NH3 + CO2 + H2O
(NH4)2CO3 -> (NH4)2CO3
- Воздействие бикарбоната аммония на воздух приводит к образованию (NH4)2CO3 для коммерческого использования. Бикарбонат аммония распадается на аммиак и углекислый газ, которые вновь реагируют с образованием (NH4)2CO3. Процесс:
NH4HCO3 -> NH3 + CO2
NH3 + CO2 -> (NH4)2CO3
Использование карбоната аммония
(NH4)2CO3 находит различное применение в различных областях, например:
- Пекари используют его в качестве средства для ухода, особенно для плоского или хрустящего печенья и крекеров. Он выделяет углекислый газ и аммиак, которые помогают тесту подняться и создать легкую текстуру. Он также улучшает вкус и аромат выпечки.
- Люди используют его как нюхательную соль, чтобы оживить людей, потерявших сознание или чувствующих себя несчастными. Он стимулирует дыхательную систему и повышает кровяное давление, выделяя пары аммиака, которые раздражают нос и легкие.
- В некоторых сиропах от кашля и отхаркивающих средствах, таких как сироп от кашля Бакли, он используется в качестве активного ингредиента. Это помогает ослабить и удалить мокроту из груди и горла за счет увеличения секреции слизи.
- Врачи используют его как рвотное средство, вызывающее рвоту в случаях отравления или передозировки. Он раздражает слизистую оболочку желудка и вызывает тошноту и рвоту, выделяя углекислый газ.
- Химики используют его в качестве реагента в некоторых химических реакциях, таких как синтез мочевины, нитрата аммония и сульфата аммония. Он также действует как буфер для поддержания pH растворов.
Вопросы:
Вопрос: Карбонат аммония является кислым или основным?
Ответ: (NH4)2CO3 — соль, способная реагировать как с кислотами, так и с основаниями. При растворении в воде он образует ионы аммония и карбонат-ионы. Ионы аммония могут действовать как слабые кислоты и отдавать протоны воде, тогда как ионы карбоната могут действовать как слабые основания и принимать протоны из воды. pH раствора зависит от относительной силы ионов аммония и карбонат-ионов. Если ионы карбоната являются более сильными основаниями, чем ионы аммония, то раствор будет основным. Раствор будет кислым, если ионы аммония являются более сильными кислотами, чем ионы карбоната являются основаниями. Если ионы аммония и ионы карбоната имеют одинаковую силу, раствор будет нейтральным.
Вопрос: Является ли карбонат аммония солью?
Ответ: Да, (NH4)2CO3 — это соль. Соль – это соединение, которое образуется, когда кислота и основание нейтрализуют друг друга. (NH4)2CO3 может образовываться при взаимодействии аммиака, слабого основания, со слабой угольной кислотой. Реакция:
2NH3 + H2CO3 -> (NH4)2CO3 + H2O
Аммиак и угольная кислота являются исходными основанием и кислотой (NH4)2CO3.
Вопрос: Имеет ли карбонат аммония (водный) запах в водной форме?
О: Да, (NH4)2CO3 (водный раствор) имеет запах в водной форме. Запах возникает из-за выделения газообразного аммиака из раствора. Газообразный аммиак имеет резкий запах, который может раздражать нос и легкие. Газообразный аммиак может выходить из раствора, поскольку он летуч и плохо растворим в воде. Количество выделяющегося газообразного аммиака зависит от температуры и концентрации раствора.
Вопрос: Какой тип атома представляет собой карбонат аммония?
Ответ: (NH4)2CO3 – это не атом, а молекула. Молекула — это группа атомов, связанных между собой общими электронами. Атом — это наименьшая единица материи с определенной химической идентичностью. (NH4)2CO3 представляет собой молекулу, состоящую из четырех разных типов атомов: азота, водорода, углерода и кислорода. Молекулярная формула (NH4)2CO3: (NH4)2CO3.
Вопрос: Сколько молей в карбонате аммония?
Ответ: Чтобы ответить на этот вопрос, нам нужно знать, сколько (NH4)2CO3 у нас есть в единицах массы или объема. Моль — это единица измерения, которая представляет собой 6,022 х 10^23 частиц вещества. Количество молей вещества можно рассчитать, разделив его массу на молярную массу или умножив его объем на молярность. Молярная масса (NH4)2CO3 составляет 96,09 г/моль. Молярность (NH4)2CO3 зависит от его растворения в воде.
Например, если у нас есть 10 г (NH4)2CO3, мы можем найти количество молей, разделив 10 г на 96,09 г/моль:
10 г / 96,09 г/моль = 0,104 моля
Если у нас есть 100 мл 0,1 М раствора (NH4)2CO3, то количество молей можно найти, умножив 100 мл на 0,1 моль/л:
100 мл х 0,1 моль/л = 0,01 моль
Вопрос: Какова химическая формула карбоната аммония?
Ответ: Химическая формула карбоната аммония: (NH4)2CO3. Эта формула показывает, что молекула (NH4)2CO3 содержит два иона аммония (NH4+) и один карбонат-ион (CO3 2-). Заряды ионов уравновешиваются, поэтому общий заряд молекулы равен нулю.
Вопрос: Сколько молей ионов аммония содержится в 6,995 г карбоната аммония?
Ответ: Чтобы ответить на этот вопрос, нам нужно выполнить два шага:
- Сначала нам нужно определить, сколько молей (NH4)2CO3 содержится в 6,995 г, разделив 6,995 г на его молярную массу (96,09 г/моль):
6,995 г / 96,09 г/моль = 0,0728 моль
- Во-вторых, нам нужно это число умножить на два, поскольку в каждом моле (NH4)2CO3 содержится два моля ионов аммония:
0,0728 моль х 2 = 0,1456 моль
Следовательно, в 6,995 г (NH4)2CO3 содержится 0,1456 моль ионов аммония.
Вопрос: Какой газ образуется при реакции соляной кислоты с карбонатом аммония?
Ответ: Когда соляная кислота реагирует с (NH4)2CO3, они подвергаются реакции двойного замещения с образованием хлорида аммония и угольной кислоты. Затем угольная кислота распадается на воду и углекислый газ. Углекислый газ — это газ, образующийся в результате этой реакции. Общее уравнение этой реакции выглядит следующим образом:
(NH4)2CO3 + 2 HCl -> 2 NH4Cl + H2CO3
H2CO3 -> H2O + CO2
Чистое ионное уравнение этой реакции:
CO3 2- + 2 H+ -> H2O + CO2
