Иодоводородная кислота (HI) – сильная кислота, образующаяся из водорода и йода. Используется в органическом синтезе и в качестве восстановителя. Он очень агрессивен и требует осторожного обращения.
| Название ИЮПАК | Иодоводородная кислота |
| Молекулярная формула | ПРИВЕТ |
| Количество CAS | 10034-85-2 |
| Синонимы | Иодоводородная кислота, йодистый водород, йодан |
| ИнЧИ | ИнЧИ=1S/HI/h1H |
Свойства иодистоводородной кислоты
Формула иодоводородной кислоты
Химическая формула йодистого водорода — HI. Он состоит из атома водорода (H), связанного с атомом йода (I). Эта простая формула представляет состав этой сильной кислоты.
Иодоводородная кислота Молярная масса
Молярная масса йодистого водорода (HI) составляет приблизительно 127,91 грамма на моль (г/моль). Это значение рассчитывается путем сложения атомных масс атома водорода и атома йода.
Температура кипения иодоводородной кислоты
Йодид водорода имеет относительно низкую температуру кипения, около -35 градусов по Цельсию (-31 градус по Фаренгейту). При этой температуре жидкая форма HI переходит в газообразное состояние.
Иодоводородная кислота Температура плавления
Температура плавления йодистого водорода составляет примерно -51 градус Цельсия (-60 градусов по Фаренгейту). При этой температуре твердая форма HI переходит в жидкое состояние.
Плотность иодистоводородной кислоты г/мл
Плотность йодистого водорода составляет примерно 2,85 грамма на миллилитр (г/мл). Это измерение плотности указывает массу HI, присутствующего в одном миллилитре вещества.
Иодоводородная кислота Молекулярный вес
Йодоводород имеет молекулярную массу примерно 127,91 г/моль. Эта величина представляет собой сумму атомных масс водорода и йода в молекуле HI.
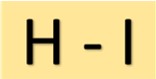
Структура иодистоводородной кислоты
Иодоводородная кислота (HI) имеет простое строение. Он состоит из атома водорода, связанного с атомом йода одинарной ковалентной связью. Такое молекулярное расположение придает HI его характерные свойства.
Растворимость иодистоводородной кислоты
Иодоводородная кислота обладает высокой растворимостью в воде. При смешивании с водой он легко растворяется, образуя бесцветный раствор. Его высокая растворимость способствует его широкому использованию в различных приложениях, включая химический синтез.
| Появление | Бесцветная жидкость |
| Удельный вес | 2,85 г/мл |
| Цвет | Бесцветный |
| Запах | Акко |
| Молярная масса | 127,91 г/моль |
| Плотность | 2,85 г/мл |
| Точка плавления | -51°С (-60°Ф) |
| Точка кипения | -35°С (-31°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | Смешивается, образует бесцветный раствор. |
| Растворимость | Растворим в органических растворителях |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | -десять |
| рН | Очень кислый (pH < 1) |
Безопасность и опасность иодоводородной кислоты
Йодистый водород (HI) представляет значительную угрозу безопасности из-за своей коррозионной природы. При попадании он может вызвать серьезные ожоги кожи и повреждение глаз. Вдыхание его паров вызывает раздражение дыхательных путей. При работе с HI следует использовать соответствующее защитное оборудование, такое как перчатки и очки. Его следует хранить в хорошо проветриваемом помещении, вдали от несовместимых веществ. При случайном проглатывании или вдыхании немедленно обратитесь за медицинской помощью. В случае разлива нейтрализовать соответствующими средствами и утилизировать как опасные отходы. Крайне важно соблюдать строгие протоколы безопасности и обращаться с ними осторожно, чтобы избежать несчастных случаев и травм.
| Символы опасности | Коррозионный |
| Описание безопасности | Вызывает серьезные ожоги кожи и повреждения глаз. Вреден при вдыхании. |
| Идентификационные номера ООН | ООН1787 |
| код ТН ВЭД | 28111990 |
| Класс опасности | 8 (Коррозионные вещества) |
| Группа упаковки | II |
| Токсичность | Очень токсичен |
Методы синтеза иодистоводородной кислоты
Йодоводород (HI) можно синтезировать различными методами. Распространенный подход предполагает прямую реакцию йода (I2) с красным фосфором (P). В этом методе I2 смешивается с красным фосфором, который действует как восстановитель. Реакция протекает в присутствии воды с образованием HI и фосфорной кислоты.
Другой метод предполагает реакцию йода с гидразингидратом (N2H4·H2O). Этот процесс требует осторожного обращения из-за потенциально опасной природы гидразингидрата. В результате реакции образуются HI и газообразный азот.
Альтернативно, реакция йода с концентрированной серной кислотой (H2SO4) также может привести к образованию HI. В этом методе йод смешивается с концентрированной серной кислотой, что приводит к образованию газообразного HI, который можно собрать и конденсировать в жидкую форму.
Важно отметить, что синтез йодистого водорода необходимо проводить с соблюдением соответствующих мер безопасности. Используемые химические вещества могут быть опасными, а реакции могут привести к образованию токсичных газов. Правильная вентиляция, защитное оборудование и соблюдение мер безопасности имеют решающее значение в процессе синтеза для обеспечения безопасного и успешного производства йодистого водорода.
Использование иодоводородной кислоты
Йодистый водород (HI) благодаря своим уникальным свойствам находит разнообразное применение в различных отраслях промышленности. Вот некоторые ключевые варианты использования:
- Органический синтез: Органическая химия использует HI в качестве основного реагента для превращения алкилгалогенидов в алканы — процесс, известный как дегалогенирование.
- Фармацевтическая промышленность: Производство различных фармацевтических соединений, в том числе йодсодержащих препаратов и йодсодержащих контрастных веществ для медицинской визуализации, связанных с HI.
- Восстановитель: HI активно действует как мощный восстановитель в химических реакциях, помогая восстанавливать ионы металлов до их элементарных форм.
- Катализ: HI активно участвует в качестве катализатора в некоторых химических реакциях, увеличивая скорость реакции и улучшая выход конкретных превращений.
- Очистка и травление. В электронной и полупроводниковой промышленности HI активно используется для процессов очистки и травления из-за его способности растворять металлы и оксиды металлов.
- Аналитическая химия: Йодометрическое титрование в аналитической химии активно использует HI для определения концентрации определенных веществ на основе их реакции с йодом.
- Обработка поверхности металла: HI активно играет роль в подготовке металлических поверхностей к гальваническому покрытию, пайке и другим процессам обработки поверхности.
- Производство йодидов: различные отрасли промышленности активно используют HI для производства соединений йодидов для различных применений в таких областях, как фотография, медицина и органический синтез.
- Лабораторный реагент: Лаборатории активно используют HI в качестве полезного реагента для многих химических реакций и экспериментов.
Универсальные свойства йодистого водорода делают его ценным инструментом в химических исследованиях, промышленных процессах и фармацевтических разработках, способствуя достижениям во многих отраслях и научным открытиям.
Вопросы:
Вопрос: Какое соединение можно добавить к иодоводородной кислоте (HI), чтобы нейтрализовать ее кислотные свойства?
Ответ: Для нейтрализации йодистого водорода и образования воды и соли можно добавить основание, такое как гидроксид натрия (NaOH).
Вопрос: Является ли иодоводородная кислота сильной кислотой?
Ответ: Да, йодистый водород является сильной кислотой, а это означает, что он полностью ионизируется в воде, выделяя ионы водорода.
Вопрос: Какова формула иодистоводородной кислоты?
A: Формула йодистого водорода — HI, обозначающая атом водорода, связанный с атомом йода.
Вопрос: Что из перечисленного является формулой иодистоводородной кислоты?
Ответ: Формула йодоводорода — HI.
Вопрос: Сколько миллилитров 0,550 М иодоводородной кислоты необходимо для реакции с 10,00 мл 0,217 М CsOH?
A: Для реакции с 10,00 мл 0,217 М CsOH требуется примерно 17,58 мл 0,550 М йодистого водорода.
Вопрос: Является ли иодоводородная кислота незаконной?
Ответ: Йодид водорода сам по себе не является незаконным, но его использование и хранение могут регулироваться из-за его потенциальной опасности и применения в незаконной деятельности.
Вопрос: Что образуют йодистый водород и сульфид магния?
A: Йодоводород и сульфид магния реагируют с образованием газообразного сероводорода (H2S) и соли йодида магния (MgI2).
Вопрос: Что произойдет, если смешать йодоводород с пищевой содой?
Ответ: Когда йодистый водород реагирует с пищевой содой (бикарбонатом натрия), образуется углекислый газ, вода и йодид натрия.
Вопрос: Как йодистый водород действует в воде?
Ответ: Йодоводород ионизируется в воде, выделяя ионы водорода (H+) и иодид-ионы (I-), в результате чего получается очень кислый раствор.
Вопрос: Чистое ионное уравнение гидроксида натрия и йодистого водорода?
A: Чистое ионное уравнение реакции между гидроксидом натрия (NaOH) и йодоводородом (HI): Na+ + OH- + H+ + I- → Na+ + I- + H2O.
