Бихромат натрия – химическое соединение. Это окислитель и высокотоксичное вещество. Он используется в различных промышленных процессах, таких как металлическое покрытие и производство пигментов.
| Название ИЮПАК | Дихромат натрия |
| Молекулярная формула | Na2Cr2O7 |
| Количество CAS | 10588-01-9 |
| Синонимы | Дихромат натрия, Дихромат натрия, Бихромат натрия |
| ИнЧИ | InChI=1S/2Cr.2Na.7O/q2*+6;2*+1;7*-2 |
Свойства дихромата натрия
Формула дихромата натрия
Формула дихромата натрия: Na2Cr2O7. Он состоит из двух атомов натрия (Na), двух атомов хрома (Cr) и семи атомов кислорода (O). Формула представляет соотношение каждого элемента в соединении.
дихромат натрия Молярная масса
Молярную массу дихромата натрия рассчитывают путем сложения атомных масс всех входящих в его состав элементов. Натрий (Na) имеет атомную массу 22,99 г/моль, хром (Cr) имеет массу 51,99 г/моль и кислород (O) имеет массу 16,00 г/моль. Сложение этих значений дает молярную массу дихромата натрия 261,97 г/моль.
Температура кипения дихромата натрия
Бихромат натрия имеет температуру кипения около 400°C (752°F). Это температура, при которой соединение переходит из жидкой фазы в газовую при нагревании при нормальном атмосферном давлении.
Дихромат натрия Температура плавления
Температура плавления дихромата натрия составляет примерно 357°C (675°F). Это температура, при которой твердое соединение переходит в жидкое состояние. Важно отметить, что температура плавления может незначительно меняться в зависимости от чистоты образца.
Плотность дихромата натрия г/мл
Плотность дихромата натрия составляет примерно 2,52 г/мл. Плотность – это мера массы вещества в единице объема. В случае бихромата натрия это значение указывает на то, что данный объем соединения является относительно тяжелым.
Молекулярный вес дихромата натрия
Молекулярная масса дихромата натрия составляет 261,97 г/моль. Это значение представляет собой сумму атомных весов всех атомов, присутствующих в молекуле соединения.
Структура дихромата натрия
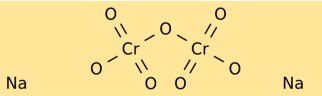
Бихромат натрия имеет кристаллическую структуру, образующую яркие красно-оранжевые кристаллы. Он состоит из ионов натрия (Na+) и дихромат-ионов (Cr2O7^2-). Дихромат-ион имеет центральный атом хрома, связанный с двумя атомами кислорода с одной стороны и тремя атомами кислорода с другой стороны.
Растворимость дихромата натрия
Бихромат натрия хорошо растворим в воде. Легко растворяется в воде, образуя желто-оранжевый раствор. На растворимость дихромата натрия в воде влияют такие факторы, как температура и pH, при этом более высокие температуры и более низкие уровни pH увеличивают его растворимость.
| Появление | Красно-оранжевые кристаллы |
| Удельный вес | 2,52 |
| Цвет | Яркий красно-оранжевый |
| Запах | Без запаха |
| Молярная масса | 261,97 г/моль |
| Плотность | 2,52 г/мл |
| Точка плавления | 357°С (675°Ф) |
| Точка кипения | 400°С (752°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим |
| Растворимость | Растворим в воде, слабо растворим в этаноле/метаноле. |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | Нет в наличии |
| рН | Нет в наличии |
Безопасность и опасность дихромата натрия
Бихромат натрия представляет значительную угрозу безопасности. Он очень токсичен при проглатывании, вдыхании или проникновении через кожу. При контакте это может привести к серьезным ожогам и повреждению глаз. Соединение также классифицируется как потенциальный канцероген, способный вызывать рак. Кроме того, он является окислителем, а это означает, что он может бурно реагировать с горючими материалами, увеличивая риск возгорания или взрыва. При работе с бихроматом натрия следует соблюдать соответствующие меры безопасности, включая использование защитной одежды, перчаток и очков. Его следует хранить в безопасном, хорошо проветриваемом помещении вдали от несовместимых веществ. В случае воздействия или проглатывания крайне важна немедленная медицинская помощь.
| Символы опасности | Коррозионное, опасно для здоровья |
| Описание безопасности | Очень токсично, коррозионно-канцерогенно. |
| Идентификационные номера ООН | ООН3086 |
| код ТН ВЭД | 28415000 |
| Класс опасности | 6.1 |
| Группа упаковки | II |
| Токсичность | Очень токсичен |
Методы синтеза бихромата натрия
Существует несколько методов синтеза дихромата натрия. Обычно используемым методом является реакция между хроматом натрия (Na2CrO4) и дихроматом натрия (Na2Cr2O7). Серная кислота (H2SO4) реагирует с хроматом натрия с образованием дихромата натрия и воды. Химическое уравнение этой реакции:
2Na2CrO4 + 2H2SO4 → Na2Cr2O7 + Na2SO4 + H2O
Другой метод предполагает окисление хромата натрия сильным окислителем, например перманганатом калия (KMnO4) . В этой реакции хромат натрия реагирует с перманганатом калия в присутствии серной кислоты с образованием дихромата натрия, диоксида марганца (MnO2) и воды.
2Na2CrO4 + 6KMnO4 + 7H2SO4 → 2Na2Cr2O7 + 6MnO2 + 7K2SO4 + 8H2O
Реакция между гидроксидом натрия (NaOH) и триоксидом хрома (CrO3) приводит к образованию дихромата натрия. Реакция протекает в водной среде с образованием дихромата натрия и воды.
2NaOH + CrO3 → Na2Cr2O7 + H2O
При применении этих синтетических методов людям следует проявлять осторожность из-за токсичной и опасной природы дихромата натрия. Использование соответствующих мер безопасности и защитного оборудования является обязательным условием для обеспечения благополучия участников процесса.
Использование дихромата натрия
Бихромат натрия находит различное применение в разных отраслях промышленности. Вот некоторые из его применений:
- Металлическое покрытие: в процессах гальваники используется дихромат натрия для нанесения защитного и декоративного покрытия на различные металлические поверхности, такие как сталь, алюминий и цинк.
- Производство пигментов: Дихромат натрия играет жизненно важную роль в производстве пигментов, таких как желтый хром и зеленый хром, которые широко встречаются в красках, чернилах и красителях.
- Консервант для древесины: бихромат натрия, обладающий сильными окислительными свойствами, предохраняет древесину от гниения, насекомых и грибков, особенно при наружном применении.
- Дубление кожи. В кожевенной промышленности дихромат натрия используется в качестве протравы в процессе обработки кожи, тем самым улучшая стойкость цвета и долговечность кожи.
- Химический синтез: Дихромат натрия действует как реагент в различных химических реакциях, включая синтез органических соединений, реакции окисления и получение других соединений хрома.
- Лабораторное применение: Бихромат натрия находит лабораторное применение для аналитических испытаний, калибровки стандартов и химических исследований.
- Текстильная промышленность: дихромат натрия улучшает стойкость цвета и способствует лучшему прилипанию красителей к ткани во время процесса крашения и печати на текстиле.
- Фотография. Дихромат натрия является важнейшим компонентом светочувствительных эмульсий и действует как окислитель в некоторых фотографических процессах.
Важно обращаться с дихроматом натрия осторожно, соблюдая инструкции по безопасности и надлежащие методы утилизации, поскольку он токсичен и оказывает воздействие на окружающую среду.
Вопросы:
Вопрос: Сколько атомов кислорода содержится в 3,00 г бихромата натрия Na2Cr2O7?
Ответ: В 3,00 г дихромата натрия содержится 6,02 x 10^22 атомов кислорода.
Вопрос: Сколько атомов кислорода содержится в 4,00 г бихромата натрия Na2Cr2O7?
Ответ: В 4,00 г дихромата натрия содержится 8,03 х 10^22 атомов кислорода.
Вопрос: Сколько атомов кислорода содержится в 5,00 г бихромата натрия Na2Cr2O7?
Ответ: В 5,00 г дихромата натрия содержится 1,00 x 10^23 атома кислорода.
Вопрос: Сколько атомов кислорода содержится в 6,00 г бихромата натрия Na2Cr2O7?
Ответ: В 6,00 г дихромата натрия содержится 1,20 х 10^23 атомов кислорода.
Вопрос: Сколько атомов кислорода содержится в 7,00 г бихромата натрия?
Ответ: В 7,00 г дихромата натрия содержится 1,40 х 10^23 атомов кислорода.
Вопрос: Паспорт безопасности дихромата натрия?
Ответ: В паспорте безопасности материала (MSDS) дихромата натрия содержится подробная информация о его свойствах, мерах предосторожности при обращении и мерах безопасности.
Вопрос: Чем можно заменить дихромат натрия?
Ответ: Альтернативы дихромату натрия включают другие соединения хрома, такие как соли трехвалентного хрома или нехромовые вещества, в зависимости от конкретного применения.
Вопрос: Для чего используется дихромат натрия?
Ответ: Дихромат натрия используется в качестве окислителя, консерванта древесины и пигмента, а также в различных промышленных процессах, таких как металлическое покрытие и дубление кожи.
Вопрос: Можно ли приготовить раствор желтого хромата из дигидрата дихромата натрия?
Ответ: Да, желтый раствор хромата можно приготовить, растворив дигидрат дихромата натрия в воде.
Вопрос: Какова формула дихромата натрия?
Ответ: Формула дихромата натрия: Na2Cr2O7.
Вопрос: Является ли дихромат натрия неорганическим?
Ответ: Да, дихромат натрия является неорганическим соединением.
Вопрос: На что тестирует бихромат натрия?
Ответ: Дихромат натрия можно использовать в целях тестирования, например, для оценки присутствия определенных веществ или мониторинга определенных химических реакций.
