Гипохлорит калия (KClO) — химическое соединение, обычно используемое в качестве дезинфицирующего средства и отбеливателя. Он имеет сильный запах и может быть опасен при неправильном обращении.
| Название ИЮПАК | Гипохлорит калия |
| Молекулярная формула | KClO |
| Количество CAS | 7778-66-7 |
| Синонимы | Хлорноватистая кислота, калиевая соль; оксихлорид калия; Хлорат калия(I) |
| ИнЧИ | InChI=1S/ClO.K/h1H;/q;+1/p-1 |
Свойства гипохлорита калия
Формула гипохлорита калия
Химическая формула гипохлорита калия — KClO. Он состоит из иона калия, атома хлора и атома кислорода. Гипохлорит калия представляет собой белое твердое вещество при комнатной температуре и имеет сильный запах хлора. Его широко используют в качестве дезинфицирующего и отбеливающего средства в различных отраслях промышленности.
Гипохлорит калия Молярная масса
Молярная масса KClO составляет 90,55 г/моль. Это сумма атомных масс составляющих элементов калия, хлора и кислорода. Молярная масса — важный параметр, используемый в стехиометрии и других химических расчетах.
Температура кипения гипохлорита калия
KClO разлагается, не достигнув точки кипения. Поэтому его точка кипения точно не определена. При нагревании разлагается на хлорид калия и газообразный кислород. Разложение KClO является экзотермической реакцией и может быть опасным при неправильном обращении.
Гипохлорит калия Температура плавления
Температура плавления KClO составляет от 100 до 102°C. Это белое твердое вещество при комнатной температуре, плавящееся при нагревании. Температура плавления является важным физическим свойством вещества и используется для идентификации и характеристики вещества.
Плотность гипохлорита калия г/мл
Плотность KClO составляет 2,35 г/мл. Это означает, что один миллилитр KClO весит 2,35 грамма. Плотность является мерой массы единицы объема вещества и является важным параметром в химических расчетах.
Гипохлорит калия Молекулярный вес
Молекулярная масса KClO составляет 90,55 г/моль. Это сумма атомных весов составляющих элементов молекулы KClO. Молекулярная масса используется в химических расчетах, таких как определение молярной массы и стехиометрии.
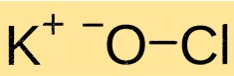
Структура гипохлорита калия
KClO имеет кристаллическую структуру. Он состоит из катионов K+ и анионов ClO-, связанных между собой ионными связями. Структура KClO аналогична структуре других ионных соединений и определяется зарядом и размером составляющих ионов.
Растворимость гипохлорита калия
KClO хорошо растворим в воде. При растворении в воде образует раствор катионов K+ и анионов ClO-. На растворимость KClO в воде влияют температура и pH. Более высокие температуры и более низкие значения pH повышают растворимость KClO в воде.
| Появление | Белый твердый |
| Удельный вес | 2.35 |
| Цвет | Белый |
| Запах | Сильный запах хлора |
| Молярная масса | 90,55 г/моль |
| Плотность | 2,35 г/мл |
| Точка плавления | 100-102°С |
| Точка кипения | Разлагается до точки кипения |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим |
| Растворимость | Растворим в воде |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Щелочная (pH 11-13) |
Безопасность и опасность гипохлорита калия
KClO может быть опасен при неправильном обращении. Это мощный окислитель, который может вступать в реакцию с органическими материалами с образованием опасных соединений. KClO также является сильным раздражителем кожи, глаз и дыхательной системы. Прямой контакт с кожей может вызвать ожоги и раздражение. Вдыхание паров KClO может вызвать кашель, хрипы и одышку. Работать со смесью следует в хорошо проветриваемом помещении, используя соответствующие средства индивидуальной защиты, такие как перчатки, очки и респиратор. В случае случайного воздействия следует немедленно обратиться за медицинской помощью.
| Символы опасности | Окислитель |
| Описание безопасности | Надевайте перчатки и средства защиты глаз/лица. Хранить вдали от горючих материалов. Избегайте контакта с кожей и глазами. |
| Идентификационные номера ООН | ООН1748 |
| код ТН ВЭД | 2828.90.10 |
| Класс опасности | 5.1 |
| Группа упаковки | II |
| Токсичность | Может быть вреден при проглатывании. Вызывает серьезные ожоги кожи и повреждения глаз. Может вызвать раздражение дыхательных путей. |
Методы синтеза гипохлорита калия
Существуют различные методы синтеза гипохлорита калия.
Распространенным методом является взаимодействие газообразного хлора с раствором гидроксида калия . В результате реакции в качестве побочных продуктов образуются KClO и хлорид калия :
Cl2 + 2KOH → KCl + KClO + H2O
Другой метод предполагает реакцию гипохлорита кальция с хлоридом калия . В результате этой реакции в качестве побочных продуктов образуются KClO и хлорид кальция:
Ca(ClO)2 + 2 KCl → 2 KClO + CaCl2
Чтобы синтезировать KClO, хлорноватистую кислоту можно ввести во взаимодействие с гидроксидом калия .
2 КОН + HOCl → KClO + KCl + H2O
Для получения KClO можно использовать электролиз, пропуская электрический ток через раствор воды и хлорида калия. В результате реакции образуются KClO, газообразный водород и гидроксид калия в качестве побочных продуктов:
2 KCl + 2 H2O → 2 КОН + Cl2 + H2
Синтезированный KClO следует хранить в сухом, прохладном месте, вдали от прямых солнечных лучей и тепла.
Использование гипохлорита калия
KClO находит различное применение в различных отраслях промышленности и применениях. Вот некоторые из его распространенных применений:
- Очистка воды: используется в качестве дезинфицирующего средства на водоочистных станциях для уничтожения бактерий и других вредных организмов.
- Отбеливатель: используется в качестве отбеливателя в текстильной промышленности для отбеливания тканей.
- Дезинфицирующее средство: используется в качестве дезинфицирующего средства в пищевой промышленности для дезинфекции поверхностей и оборудования, контактирующих с пищевыми продуктами.
- Уход за бассейном: используется в качестве дезинфицирующего средства и альгицида в плавательных бассейнах, чтобы поддерживать воду чистой и прозрачной.
- Стерилизация: используется для стерилизации в медицинских учреждениях и лабораториях для дезинфекции оборудования и поверхностей.
- Дезодоратор: используется в качестве дезодоратора на очистных сооружениях для нейтрализации неприятных запахов.
- Целлюлозно-бумажная промышленность: Используется в целлюлозно-бумажной промышленности в качестве отбеливателя для бумажной продукции.
- Сельское хозяйство: используется в сельском хозяйстве в качестве пестицида и фунгицида для защиты сельскохозяйственных культур от вредителей и болезней.
- Дезинфицирующее средство: используется в качестве дезинфицирующего средства в бытовых чистящих средствах для уничтожения микробов и бактерий.
- Нефтяная и газовая промышленность: используется в нефтегазовой промышленности для обработки нефтяных скважин и трубопроводов с целью борьбы с бактериями и предотвращения коррозии.
Вопросы:
Вопрос: Что такое гипохлорит калия?
Ответ: Гипохлорит калия — это химическое соединение формулы KClO, которое обычно используется в качестве дезинфицирующего средства, отбеливателя и химиката для очистки воды.
Вопрос: Каков pH раствора 0,42 М KClO? [Ка(HClO) = 4,0 × 10–8]
A: pH 0,42 М раствора KClO можно рассчитать, используя значение Ka его сопряженной кислоты HClO. pH составляет около 12,69.
Вопрос: Что такое гипохлорит натрия и гидроксид калия?
Ответ: Гипохлорит натрия — это химическое соединение формулы NaClO, обычно используемое в качестве отбеливателя и дезинфицирующего средства. Гидроксид калия — химическое соединение формулы КОН, обычно используемое в производстве мыла и в качестве лабораторного реагента.
Вопрос: Каков pH 0,116 М водного раствора KClO?
A: pH 0,116 М водного раствора KClO можно рассчитать, используя значение Kb его сопряженного основания ClO-. pH составляет около 11,31.
Вопрос: Каков pH 0,191 М водного раствора KClO?
A: pH 0,191 М водного раствора KClO можно рассчитать, используя значение Kb его сопряженного основания ClO-. pH составляет около 11,92.
Вопрос: Растворим ли KClO?
Ответ: Да, KClO растворим в воде и образует щелочной раствор.
Вопрос: Могу ли я смешивать гипохлорит натрия и гипохлорит калия?
Ответ: Смешивать гипохлорит натрия и KClO не рекомендуется, поскольку это может вызвать химическую реакцию с выделением тепла, газов и потенциально вредных побочных продуктов.
