NH4OH или гидроксид аммония представляет собой прозрачный бесцветный раствор, широко известный как бытовой аммиак. Это сильнощелочной раствор с pH 11-12. Он используется в качестве чистящего средства, при производстве удобрений и в некоторых пищевых продуктах в качестве уходового средства.
| Название ИЮПАК | Гидроксид аммония |
| Молекулярная формула | NH4OH |
| Количество CAS | 1336-21-6 |
| Синонимы | Раствор аммиака, водный раствор аммиака, бытовой аммиак. |
| ИнЧИ | ИнХI=1S/H5NO/c1-5(2,3)4/h(H,1,2,3,4)/p+1 |
Свойства гидроксида аммония
Формула гидроксида аммония
Химическая формула гидроксида аммония – NH4OH. Формула представляет относительное количество и типы атомов в соединении. «N» представляет собой азот, «H» представляет собой водород, а «O» представляет собой кислород. Индексные числа в формуле указывают количество атомов каждого элемента в соединении. В случае гидроксида аммония имеется один атом азота, четыре атома водорода и один атом кислорода. Формула гидроксида аммония представляет собой ионное соединение, состоящее из положительно заряженных ионов аммония (NH4+) и отрицательно заряженных гидроксид-ионов (OH-).
Гидроксид аммония Ph
pH гидроксида аммония (NH4OH) является основным, его значение составляет около 11. Это означает, что гидроксид аммония имеет высокую концентрацию гидроксид-ионов (OH-) и является очень щелочным. pH растворов гидроксида аммония может варьироваться в зависимости от концентрации, температуры и других факторов, но обычно он считается сильным основанием с pH выше 7,0. Гидроксид аммония широко используется в различных промышленных и бытовых целях, таких как очистка и регулирование pH, из-за его высокой щелочности. Однако важно обращаться с гидроксидом аммония с осторожностью, поскольку при неправильном обращении он может вызвать коррозию и стать опасным.
Гидроксид аммония SDS
MSDS означает «Паспорт безопасности материала», который представляет собой документ, содержащий информацию о свойствах, обращении, хранении и утилизации химического вещества. Паспорт безопасности для гидроксида аммония (NH4OH) предоставит информацию о его физических и химических свойствах, потенциальных последствиях для здоровья, опасности пожара и взрыва, а также любых защитных мерах, которые следует принимать при обращении или использовании этого вещества.
Паспорт безопасности для гидроксида аммония также будет включать информацию о его токсичности, реакционной способности и воспламеняемости, а также о любых соответствующих мерах первой помощи в случае воздействия. Кроме того, паспорт безопасности будет содержать информацию о правильном хранении и утилизации гидроксида аммония, включая любые необходимые меры предосторожности для предотвращения разливов или утечек.
Растворимость гидроксида аммония
Гидроксид аммония (NH4OH) хорошо растворим в воде. Образует прозрачный, бесцветный, сильнощелочной раствор с характерным запахом. Растворимость гидроксида аммония в воде зависит от температуры и концентрации, при этом более высокие температуры и концентрации приводят к увеличению растворимости.
Как правило, гидроксид аммония легко растворяется в воде, образуя раствор от нейтрального до щелочного с pH примерно от 9 до 11. На растворимость гидроксида аммония в воде также влияют другие факторы, такие как давление, температура и наличие других факторов. растворенные вещества.
гидроксид аммония Молярная масса
Молярная масса гидроксида аммония (NH4OH) составляет 35,05 г/моль. Это значение важно для определения количества гидроксида аммония в образце, а также для химических реакций с участием этого соединения. Чтобы определить молярную массу вещества, атомные массы всех элементов соединения складываются. В случае гидроксида аммония молярная масса рассчитывается путем сложения атомных масс азота (14,01 г/моль), водорода (1,01 г/моль) и кислорода (16,00 г/моль).
Температура кипения гидроксида аммония
Температура кипения гидроксида аммония составляет примерно 38°С. Это значение важно для определения условий, при которых соединение переходит из жидкого состояния в газообразное. Найдите температуру кипения гидроксида аммония, измерив давление пара вещества. Давление пара — это давление, оказываемое паром над жидкостью в закрытом сосуде. Имейте в виду, что температура кипения также может меняться в зависимости от давления и температуры.
Температура плавления гидроксида аммония
Температура плавления гидроксида аммония составляет -77°С. Это значение важно для определения условий, при которых соединение переходит из твердого состояния в жидкость. Измерьте температуру плавления гидроксида аммония, оценив прочность его межмолекулярных связей. Помните, что температура плавления может меняться в зависимости от давления и температуры окружающей среды.
Плотность гидроксида аммония г/мл
Плотность гидроксида аммония составляет примерно 0,91 г/мл. Эта величина важна для определения количества гидроксида аммония в данном объеме, а также для расчета массы вещества в данном объеме. Определите плотность гидроксида аммония, разделив его массу на занимаемый им объем. Имейте в виду, что плотность вещества может меняться в зависимости от температуры и давления.
Гидроксид аммония Молекулярный вес
Молекулярная масса гидроксида аммония составляет 35,05 г/моль. Это значение важно для определения количества гидроксида аммония в образце, а также для химических реакций с участием этого соединения. Рассчитайте молекулярную массу гидроксида аммония, сложив атомные массы азота (14,01 г/моль), водорода (1,01 г/моль) и кислорода (16,00 г/моль).
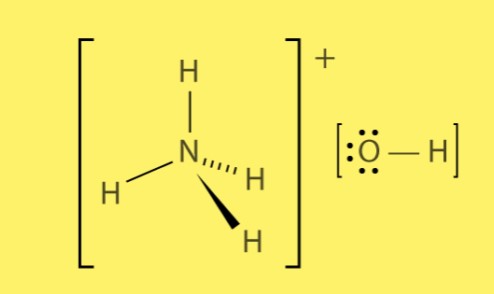
Структура гидроксида аммония
Гидроксид аммония образуется из комбинации положительно заряженных ионов аммония (NH4+) и отрицательно заряженных ионов гидроксида (OH-). Ионные связи между этими ионами создают сильное электростатическое притяжение, приводящее к образованию соединения.
| Появление | Прозрачная бесцветная жидкость |
| Удельный вес | 0,91 г/мл |
| Цвет | Бесцветный |
| Запах | Резкий запах, похожий на аммиак. |
| Молярная масса | 35,05 г/моль |
| Плотность | 0,91 г/мл |
| Точка плавления | -77°С |
| Точка кипения | 38°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | Полностью растворим |
| Растворимость | Растворим в этаноле и метаноле. |
| Давление газа | 17,5 мм рт.ст. при 20°C |
| Плотность пара | 0,6 (воздух = 1) |
| пКа | 10.64 |
| рН | 11,6 (1М раствор) |
Безопасность и опасность гидроксида аммония
Гидроксид аммония является сильнощелочным раствором и может быть опасен при неправильном обращении. При вдыхании может вызвать раздражение кожи и глаз, а также проблемы с дыханием. При попадании на кожу запейте большим количеством воды и при необходимости обратитесь к врачу. При проглатывании это может привести к серьезному вреду или смерти. Поэтому важно хранить его в недоступном для детей и домашних животных месте. Он также легко воспламеняется, поэтому его следует хранить вдали от источников тепла и пламени. При использовании гидроксида аммония важно носить защитные средства, такие как перчатки и средства защиты глаз. В случае разлива нейтрализовать кислотой и очистить при наличии достаточной вентиляции. Соблюдение техники безопасности и правильное хранение имеют важное значение при обращении с гидроксидом аммония.
| Символы опасности | Коррозионный |
| Описание безопасности | С26, С37/39 |
| Идентификационные номера ООН | ООН2672 |
| код ТН ВЭД | 2814.10.00 |
| Класс опасности | 8 |
| Группа упаковки | II |
| Токсичность | Вреден при проглатывании, вдыхании или попадании на кожу. Может вызвать сильное раздражение и ожоги. |
Методы синтеза гидроксида аммония
Гидроксид аммония можно синтезировать двумя основными методами: хлоридно-аммиачным процессом и аммиачным процессом.
Процесс хлорида аммония включает реакцию газообразного аммиака и соляной кислоты с образованием хлорида аммония и воды:
NH3 + HCl → NH4Cl + H2O
Затем хлорид аммония растворяют в воде с получением раствора гидроксида аммония. Этот раствор можно дополнительно концентрировать путем перегонки с получением концентрированного раствора гидроксида аммония.
Процесс аммиака включает прямую реакцию газообразного аммиака и воды с образованием гидроксида аммония и газообразного водорода:
NH3 + H2O → NH4OH + H2
Производство гидроксида аммония можно контролировать, регулируя температуру и давление во время экзотермической реакции, в результате чего получается раствор, который можно очистить и сконцентрировать с помощью методов промывки и дистилляции. В промышленном производстве гидроксида аммония обычно используется процесс аммиака из-за его простоты и эффективности, но процесс хлорида аммония служит резервным вариантом во время нехватки аммиака.
Использование гидроксида аммония
Гидроксид аммония находит широкое применение в различных отраслях промышленности. Некоторые из его распространенных применений:
- В различных бытовых и промышленных применениях гидроксид аммония используется в качестве чистящего средства для эффективного удаления жира, масел и грязи с поверхностей.
- В пищевой промышленности он используется в качестве дезинфицирующего средства для уничтожения бактерий и патогенов на поверхностях, контактирующих с пищевыми продуктами. В сельском хозяйстве гидроксид аммония обеспечивает необходимый азот в качестве удобрения для роста растений и является ключевым ингредиентом в производстве удобрений из нитрата аммония.
- В фармацевтической промышленности он используется при производстве некоторых лекарств и в качестве регулятора pH при производстве некоторых медицинских изделий.
- В хлебопекарной промышленности гидроксид аммония используется в качестве освежителя, способствующего подъему теста, а также он действует как ароматизатор в некоторых пищевых продуктах и как регулятор pH при производстве некоторых продуктов питания и напитков.
- В текстильной промышленности гидроксид аммония нейтрализует кислоты и регулирует уровень pH в текстильном производстве. При очистке воды он регулирует уровень pH и удаляет примеси.
В целом гидроксид аммония — универсальное и широко используемое химическое вещество, находящее применение в различных отраслях промышленности. Однако важно обращаться с гидроксидом аммония безопасно, поскольку при неправильном обращении он может быть опасным.
Вопросы:
Растворим ли гидроксид аммония?
Да, гидроксид аммония хорошо растворяется в воде. Образует прозрачный, бесцветный, сильнощелочной раствор с характерным запахом. Растворимость гидроксида аммония в воде зависит от температуры и концентрации, при этом более высокие температуры и концентрации приводят к увеличению растворимости.
Какова химическая формула гидроксида аммония?
Химическая формула гидроксида аммония – NH4OH.
Какая формула гидроксида аммония?
Формула гидроксида аммония NH4OH.
Является ли гидроксид аммония сильным основанием?
Да, гидроксид аммония считается сильным основанием. Он полностью диссоциирует в воде с образованием гидроксид-ионов (OH-) и ионов аммония (NH4+), что делает его очень щелочным с pH около 11. Такая высокая щелочность делает его полезным химическим веществом в различных промышленных и бытовых применениях, таких как очистка и очистка. Регулировка pH. Однако важно обращаться с гидроксидом аммония осторожно, поскольку при неправильном обращении он может вызывать коррозию и быть опасным.
название соединения nh4oh
Название химического соединения NH4OH – гидроксид аммония.
имя nh4oh
Название NH4OH – гидроксид аммония.
