Бензоилхлорид — химическое соединение, используемое в различных отраслях промышленности. Он реагирует с другими веществами с образованием производных, таких как перекись бензоила, распространенного ингредиента в средствах от прыщей.
| Название ИЮПАК | Бензоилхлорид |
| Молекулярная формула | C7H5ClO |
| Количество CAS | 98-88-4 |
| Синонимы | Бензойная кислота, хлорид, бензолкарбонилхлорид, фенилкарбонилхлорид |
| ИнЧИ | ИнХИ=1S/C7H5ClO/c8-6-7(9)4-2-1-3-5-7/h1-5H |
Свойства бензоилхлорида
Формула бензоилхлорида
Формула бензоилхлорида: C7H5ClO. Он представляет собой расположение атомов углерода, водорода, хлора и кислорода в соединении. Формула дает ценную информацию об элементном и структурном составе бензоилхлорида.
Бензоилхлорид Молярная масса
Молярную массу бензоилхлорида рассчитывают путем сложения атомных масс составляющих его элементов. В этом случае углерод имеет молярную массу 12,01 г/моль, водород имеет молярную массу 1,01 г/моль, хлор имеет молярную массу 35,45 г/моль и кислород имеет молярную массу 16,00 г/моль. Сложив эти значения, молярная масса бензоилхлорида оказывается примерно 140,57 г/моль.
Температура кипения бензоилхлорида
Бензоилхлорид имеет температуру кипения примерно 197-198°С. Это температура, при которой жидкое соединение переходит в газообразное состояние при стандартном атмосферном давлении. Температура кипения дает представление о характеристиках летучести и испарения бензоилхлорида.
Температура плавления бензоилхлорида
Температура плавления бензоилхлорида составляет примерно -1°С. Это означает температуру, при которой твердая форма бензоилхлорида переходит в жидкое состояние. Температура плавления указывает на физические свойства соединения и его способность переходить из одной фазы в другую.
Плотность бензоилхлорида г/мл
Бензоилхлорид имеет плотность примерно 1,21 г/мл. Плотность относится к массе вещества в единице объема. Это свойство дает информацию о компактности или концентрации бензоилхлорида в заданном объеме.
Бензоилхлорид Молекулярный вес
Молекулярная масса бензоилхлорида рассчитывается путем сложения атомных масс всех атомов молекулы. В этом случае молекулярная масса бензоилхлорида составляет примерно 140,57 г/моль. Это важный параметр, используемый в стехиометрических расчетах и для определения количества бензоилхлорида в химических реакциях.
Структура бензоилхлорида
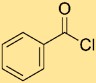
Структура бензоилхлорида состоит из бензольного кольца, связанного с карбонильной группой (-C=O), и атома хлора (-Cl), непосредственно связанного с атомом углерода карбонильной группы. Такое расположение может быть представлено PhCOCl, где «Ph» представляет собой бензольное кольцо. Структура подчеркивает взаимосвязь и связь атомов бензоилхлорида.
Растворимость бензоилхлорида
Бензоилхлорид плохо растворяется в воде. Он проявляет более высокую растворимость в органических растворителях, таких как ацетон, эфир и бензол. Характеристики растворимости бензоилхлорида влияют на его применение и взаимодействие с другими веществами в различных химических процессах.
| Появление | Бесцветная или бледно-желтая жидкость |
| Удельный вес | 1,21 г/мл |
| Цвет | От бесцветного до бледно-желтого |
| Запах | Раздражающий и резкий запах |
| Молярная масса | 140,57 г/моль |
| Плотность | 1,21 г/мл |
| Точка плавления | -1°С |
| Точка кипения | 197-198°С |
| Мигающая точка | 77°С |
| Растворимость в воде | Реагирует |
| Растворимость | Растворим в органических растворителях, таких как ацетон, эфир и бензол. |
| Давление газа | 4,95 мм рт.ст. при 25°C |
| Плотность пара | 5.3 |
| пКа | 4.18 |
| рН | Неприменимо (кислота при растворении в воде) |
Безопасность и опасность бензоилхлорида
Бензоилхлорид представляет некоторую угрозу безопасности, и с ним следует обращаться с осторожностью. Он сильно раздражает кожу, глаза и дыхательную систему, вызывая ожоги и сильный дискомфорт при контакте. Вдыхание его паров может вызвать раздражение дыхательных путей и повреждение легких. При работе с бензоилхлоридом важно использовать соответствующие защитные средства, такие как перчатки, очки и респиратор. Соединение огнеопасно и может воспламениться при воздействии тепла или пламени с выделением токсичных паров. Кроме того, он бурно реагирует с водой, спиртами и основаниями, что может привести к пожару или взрыву. Для минимизации рисков необходимо соблюдать надлежащие процедуры хранения, обращения и утилизации.
| Символы опасности | Коррозионный, Токсичный |
| Описание безопасности | Избегайте контакта с кожей и глазами. Используйте в хорошо проветриваемом помещении. Обращайтесь с соответствующими защитными средствами. |
| Идентификационные номера ООН | 1736 год |
| код ТН ВЭД | 2916.31.00 |
| Класс опасности | 8 (Коррозионный), 6,1 (Токсичный) |
| Группа упаковки | II (средний уровень) |
| Токсичность | Очень токсично и коррозийно. |
Методы синтеза бензоилхлорида
Существует несколько методов синтеза бензоилхлорида. Распространенным подходом является окисление бензальдегида с использованием подходящего окислителя, такого как газообразный хлор или пентахлорид фосфора (PCl5). В этом методе бензальдегид смешивается с окислителем в контролируемых условиях, в результате чего образуется бензоилхлорид.
Другой метод включает реакцию между перекисью бензоила и газообразным хлористым водородом . Пероксид бензоила действует как радикальный инициатор, ускоряя реакцию с хлористым водородом с образованием хлористого бензоила.
Чтобы получить бензоилхлорид, бензойную кислоту можно обработать тионилхлоридом (SOCl2) или трихлоридом фосфора (PCl3) в условиях кипения с обратным холодильником. В результате реакции образуется хлорангидрид в качестве промежуточного продукта, который затем превращается в бензоилхлорид.
Кроме того, реакция трихлорида бензоила с окисью углерода (CO) в присутствии катализатора, такого как медь, также может привести к синтезу хлористого бензоила.
Важно отметить, что эти методы следует проводить в хорошо проветриваемом помещении с соблюдением надлежащих мер безопасности, так как бензоилхлорид является опасным соединением. Для обеспечения безопасного процесса синтеза необходимы осторожное обращение и соблюдение надлежащих лабораторных протоколов.
Использование бензоилхлорида
Бензоилхлорид находит различное применение в различных отраслях промышленности благодаря своим универсальным химическим свойствам. Вот некоторые известные приложения:
- Фармацевтическая промышленность. Фармацевтическая промышленность использует бензоилхлорид в качестве ключевого промежуточного продукта для синтеза фармацевтических соединений, включая анальгетики, антисептики и антигистаминные средства.
- Полимерная промышленность: В полимерной промышленности бензоилхлорид действует как мономер, способствуя структурной стабильности и термостойкости полимеров, таких как поликарбонаты, полиамиды и полиэфиры.
- Органический синтез: Бензоилхлорид служит реагентом в реакциях ацилирования, облегчая введение бензоильной группы в органические молекулы.
- Агрохимикаты: Бензоилхлорид играет решающую роль в защите сельскохозяйственных культур и борьбе с вредителями, способствуя синтезу гербицидов и инсектицидов.
- Производство красителей: Бензоилхлорид является прекурсором для производства различных красителей и пигментов, необходимых для окраски текстиля, пластмасс и печатных красок.
- Парфюмерно-парфюмерная промышленность: В парфюмерно-парфюмерной промышленности бензоилхлорид используется для синтеза духов и ароматических соединений, улучшая тем самым их ароматические характеристики.
- Химические исследования: исследовательские лаборатории применяют бензоилхлорид в синтезе новых химических соединений, способствуя разработке инновационных материалов и фармацевтических продуктов.
- Резиновая промышленность. Резиновая промышленность использует бензоилхлорид в качестве сшивающего агента для изменения свойств каучука, тем самым улучшая его долговечность и прочность.
- Производство клеев: производители используют бензоилхлорид для производства клеев и герметиков, улучшающих клеящие свойства.
- Текстильная промышленность: В текстильной промышленности бензоилхлорид действует как катализатор и стабилизатор при производстве синтетических волокон, таких как нейлон, полиэстер и эластан, обеспечивая их качество и эксплуатационные характеристики.
Эти различные применения демонстрируют важность бензоилхлорида в различных отраслях промышленности.
Вопросы:
Вопрос: Какой из следующих реагентов превращает бензоилхлорид в фенилпропилкетон?
Ответ: Реагент, который превращает бензоилхлорид в фенилпропилкетон, представляет собой реактив Гриньяра фенилмагнийбромида (PhMgBr) с последующей реакцией с пропилгалогенидом.
Вопрос: Какой продукт образуется при реакции бензоилхлорида с 4-хлорфенолом?
A: Продукт, образующийся в результате реакции бензоилхлорида с 4-хлорфенолом, представляет собой 4-хлорбензоилфенол.
Вопрос: Как найти выход аммонолиза бензоилхлорида?
А: Выход аммонолиза бензоилхлорида можно определить, разделив количество полученного желаемого продукта на теоретический выход и умножив на 100, чтобы выразить его в процентах.
Вопрос: Бензоилхлорид или бензилхлорид более электрофильны?
Ответ: Бензоилхлорид более электрофилен, чем бензилхлорид, из-за присутствия карбонильной группы с высокой электроноакцепторной способностью.
Вопрос: Какой из следующих реагентов используется в следующей реакции? бензойная кислота в бензоилхлорид, гидролиз бензоилхлорида?
Ответ: Реагентом, используемым при превращении бензойной кислоты в бензоилхлорид, является тионилхлорид (SOCl2), а при гидролизе бензоилхлорида — вода или водное основание.
Вопрос: Какие продукты образуются при реакции бензоилхлорида с циклогексанолом?
A: Продукты, образующиеся в результате реакции бензоилхлорида с циклогексанолом, представляют собой циклогексилбензоат и хлористый водород (HCl).
Вопрос: Как сушить бензоилхлорид?
A: Бензоилхлорид можно высушить путем добавления подходящего осушителя, такого как безводный хлорид кальция или безводный сульфат магния, с последующей фильтрацией.
Вопрос: Что более электрофильно: бензоилхлорид или бензилхлорид?
Ответ: Бензоилхлорид более электрофилен, чем бензилхлорид, из-за присутствия карбонильной группы, которая подавляет электронную плотность и увеличивает электрофильность.
Вопрос: Растворим ли бензоилхлорид в воде?
Ответ: Нет, бензоилхлорид не растворяется в воде. Реагирует с водой с образованием бензойной и соляной кислот.
