Ацетофенон или метилфенилкетон представляет собой ароматическое органическое соединение формулы C8H8O. Он используется в производстве духов и смол, а также в качестве растворителя и промежуточного продукта в фармацевтических препаратах.
| Название ИЮПАК | 1-фенилэтанон |
| Молекулярная формула | C8H8O |
| Количество CAS | 98-86-2 |
| Синонимы | Метилфенилкетон, фенилметилкетон, АП, ацетилбензол, бензоилметил, этилфенилкетон, Гипнон |
| ИнЧИ | ИнЧИ=1S/C8H8O/c1-7(9)8-5-3-2-4-6-8/h2-6H,1H3 |
Структура ацетофенона
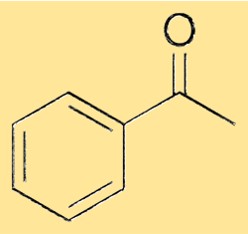
Структура ацетофенона состоит из фенильной группы, связанной с карбонильной группой одинарной связью. Карбонильная группа состоит из атома углерода, дважды связанного с атомом кислорода. Фенильная группа представляет собой шестичленное кольцо из атомов углерода, к которому присоединены пять атомов водорода, шестое положение занимает карбонильный атом углерода. Эта структура придает ацетофенону его характерные свойства и позволяет ему служить универсальным сырьем для синтеза различных химических веществ.
Точка плавления ацетофенона
Ацетофенон имеет температуру плавления -15,7°C. Точка плавления — это температура, при которой твердое вещество превращается в жидкость при постоянном давлении. Ацетофенон представляет собой кристаллическое твердое вещество при комнатной температуре и имеет относительно низкую температуру плавления по сравнению с другими аналогичными соединениями. Температура плавления соединения определяется его молекулярной структурой и силой межмолекулярных сил.
ИК спектр ацетофенона
В ИК-спектре ацетофенона наблюдаются характерные пики при 1705 см^-1, что соответствует карбонильной группе, и при 3030-3100 см^-1, что соответствует растяжению ароматического СН. Эти пики предоставляют важную информацию о функциональных группах, присутствующих в молекуле.
Молярная масса of ацетофенон:
Ацетофенон имеет молярную массу 120,15 г/моль. Это ароматическое органическое соединение с карбонильной группой, присоединенной к фенильному кольцу. Молярная масса представляет собой сумму атомных масс атомов, содержащихся в одном моле соединения. В случае ацетофенона он имеет 8 атомов углерода, 8 атомов водорода и один атом кислорода, что дает всего 17 атомов в молекуле. Молярная масса является важным свойством соединения, поскольку она используется для расчета количества вещества в данной пробе, что необходимо для различных применений в химии и промышленности.
Температура кипения ацетофенона
Ацетофенон имеет температуру кипения 202°С. Точка кипения — это температура, при которой жидкость превращается в газ при постоянном давлении. Ацетофенон является летучим органическим соединением и имеет относительно высокую температуру кипения по сравнению с другими аналогичными соединениями. Температура кипения соединения определяется силой его межмолекулярных сил, которые удерживают молекулы вместе в жидком или твердом состоянии. В случае ацетофенона он имеет полярную карбонильную группу, которая может образовывать водородные связи с другими молекулами ацетофенона, что усиливает межмолекулярные силы и повышает температуру кипения.
Плотность метилфенилкетона г/мл
Метилфенилкетон имеет плотность 1,03 г/мл при комнатной температуре. Плотность – это масса вещества в единице объема. Метилфенилкетон при комнатной температуре представляет собой жидкость и имеет относительно высокую плотность по сравнению с другими аналогичными соединениями. Плотность соединения определяется его молекулярной массой и плотностью его молекул в данном объеме. В случае метилфенилкетона он имеет относительно высокую молекулярную массу и относительно компактную молекулярную структуру, что делает упаковку его молекул более эффективной и увеличивает плотность.
Молекулярный вес метилфенилкетона
Метилфенилкетон имеет молекулярную массу 120,15 г/моль. Молекулярная масса – это сумма атомных весов всех атомов молекулы. Метилфенилкетон имеет 8 атомов углерода, 8 атомов водорода и один атом кислорода, что дает в общей сложности 17 атомов в молекуле. Молекулярная масса является важным свойством соединения, поскольку она используется для расчета количества вещества в данном образце, что необходимо для различных применений в химии и промышленности.
| Появление | Бесцветная или бледно-желтая жидкость |
| Удельный вес | 1,028-1,031 при 25°С |
| Цвет | От бесцветного до бледно-желтого |
| Запах | Сладкий, цветочный, медовый |
| Молярная масса | 120,15 г/моль |
| Плотность | 1,03 г/мл при 25°C |
| Точка плавления | -15,7°С |
| Точка кипения | 202°С |
| Мигающая точка | 78°С |
| Растворимость в воде | 3,3 г/л при 25°C |
| Растворимость | Растворим в спирте, эфире, хлороформе и бензоле. |
| Давление газа | 0,27 мм рт.ст. при 25°C |
| Плотность пара | 4,15 (воздух = 1) |
| пКа | 10.01 |
| рН | Неприменимо (метилфенилкетон не является ни кислотой, ни основанием) |
Безопасность и опасность метилфенилкетона
Метилфенилкетон может быть опасен при неправильном обращении. При контакте или вдыхании может вызвать раздражение кожи, глаз и дыхательной системы. Прямое воздействие высоких концентраций паров метилфенилкетона может вызвать головную боль, головокружение или тошноту. Проглатывание метилфенилкетона может вызвать раздражение желудочно-кишечного тракта, рвоту или диарею. Метилфенилкетон также легко воспламеняется и может образовывать взрывоопасные смеси с воздухом. Хранить следует в прохладном, сухом, хорошо проветриваемом месте вдали от источников возгорания. При работе с метилфенилкетоном следует надевать средства индивидуальной защиты, такие как перчатки, защитные очки и респиратор.
| Символы опасности | Xi: Раздражающий, F: Легковоспламеняющийся. |
| Описание безопасности | S16: Хранить вдали от источников воспламенения – Не курить, S26: При попадании в глаза немедленно промыть большим количеством воды и обратиться к врачу, S36: Носить подходящую защитную одежду, S37: Носить подходящие перчатки, S39: Носить подходящую защитная одежда. защита лица |
| Идентификационные номера ООН | ООН 2319 |
| код ТН ВЭД | 291439 |
| Класс опасности | 3 (Горючие жидкости) |
| Группа упаковки | III |
| Токсичность | Метилфенилкетон классифицируется как раздражитель глаз 3-й категории и раздражитель кожи 4-й категории. Он не считается канцерогеном или мутагеном. Пероральная LD50 (смертельная доза для 50% испытуемых) для крыс составляет примерно 3000 мг/кг. Это не считается значительным экологическим риском. |
Методы синтеза метилфенилкетона
Существуют различные методы синтеза метилфенилкетона.
Распространенным методом является ацилирование бензола по Фриделю-Крафтсу ацетилхлоридом в присутствии катализатора на основе кислоты Льюиса, такого как хлорид алюминия. В результате этой реакции в качестве побочных продуктов образуются метилфенилкетон и хлористый водород.
Другой метод — окисление этилбензола воздухом или кислородом в присутствии металлического катализатора, такого как кобальт или марганец. В результате этой реакции в качестве побочных продуктов образуются метилфенилкетон и уксусная кислота.
Метилфенилкетон можно синтезировать путем восстановления фенилацетона с использованием восстановителей, таких как боргидрид натрия или алюмогидрид лития. В результате этой реакции в качестве побочных продуктов образуются метилфенилкетон и соответствующий спирт.
Другой метод включает реакцию бензоилхлорида с этилбензолом в присутствии катализатора на основе хлорида алюминия с образованием метилфенилкетона и хлористого водорода в качестве побочных продуктов.
Использование метилфенилкетона
Метилфенилкетон имеет несколько применений в различных отраслях промышленности.
- Метилфенилкетон широко используется в качестве растворителя различных смол, эфиров целлюлозы и пластмасс.
- В пищевой промышленности метилфенилкетон используется в качестве ароматизатора, особенно для вкусов вишни и миндаля.
- Парфюмерная промышленность использует метилфенилкетон в качестве сырья для производства духов и другой ароматизированной продукции.
- Различные химические вещества, такие как фармацевтические препараты, агрохимикаты и красители, синтезируются с использованием метилфенилкетона.
- Метилфенилкетон служит промежуточным продуктом в производстве фенилацетона, прекурсора для синтеза амфетаминов.
- Кумарин, ароматизатор, используемый в мыле и моющих средствах, синтезируется из метилфенилкетона.
- Реагенты органической химии используют метилфенилкетон в качестве реагента для синтеза различных соединений.
- Метилфенилкетон служит сырьем для производства других химических веществ, таких как стирол и метилстирол.
В целом, метилфенилкетон имеет широкий спектр применения в различных отраслях промышленности благодаря своим универсальным свойствам и использованию.
Вопросы:
Вопрос: Полярен ли ацетофенон?
Ответ: Да, ацетофенон полярен из-за наличия карбонильной группы (C=O) и фенильного кольца, которое создает дипольный момент.
Вопрос: Бензальдегид или ацетофенон более полярны?
Ответ: Бензальдегид более полярен, чем ацетофенон, поскольку он имеет более высокий дипольный момент из-за присутствия альдегидной группы (CHO) в дополнение к фенильному кольцу.
Вопрос: ИК-спектр ацетофенона?
A: ИК-спектр ацетофенона показывает сильную и широкую полосу поглощения около 1700 см^-1, которая характерна для валентного колебания карбонила (C=O). Также наблюдаются пики в районе 3000-3100 см^-1, что соответствует валентным колебаниям ароматического CH.
Вопрос: От ацетофенона к бензойной кислоте?
Ответ: Ацетофенон можно превратить в бензойную кислоту путем окисления с использованием окислителя, такого как перманганат калия или хромовая кислота. Эта реакция приводит к разрыву связи углерод-углерод, прилегающей к карбонильной группе, с последующим окислением полученного промежуточного продукта с образованием бензойной кислоты.
Вопрос: От бензола к ацетофенону?
Ответ: Бензол можно превратить в ацетофенон путем ацилирования по Фриделю-Крафтсу с использованием ацетилхлорида или уксусного ангидрида в присутствии катализатора на основе кислоты Льюиса, такого как хлорид алюминия. В результате этой реакции происходит замещение атома водорода бензола ацетильной группой (-COCH3) с последующей перегруппировкой с образованием ацетофенона.
