Ацетилхлорид или C2H3ClO — бесцветная дымящая жидкость с резким запахом. В основном он используется в качестве реагента в органическом синтезе и как ацетилирующий агент при производстве фармацевтических препаратов и красителей.
| Название УПАК | Ацетилхлорид |
| Молекулярная формула | C2H3ClO |
| Количество CAS | 75-36-5 |
| Синонимы | Этаноилхлорид, хлорид уксусной кислоты, хлорид уксуса, хлорацетилхлорид, AcCl |
| ИнЧИ | ИнХИ=1S/C2H3ClO/c1-2(3)4/h1H3 |
Свойства ацетилхлорида
ацетилхлорид Молярная масса
Ацетилхлорид химической формулы C2H3ClO имеет молярную массу примерно 78,50 г/моль. Это рассчитывается путем сложения атомных масс каждого атома в молекуле: углерода (12,01 г/моль), водорода (1,01 г/моль), хлора (35,45 г/моль) и кислорода (16,00 г/моль). Молярная масса ацетилхлорида важна в стехиометрических расчетах для определения количества реагирующих веществ и продуктов химических реакций.
Температура кипения ацетилхлорида
Температура кипения ацетилхлорида составляет 51,5°C (124,7°F) при стандартном атмосферном давлении. Низкая температура кипения в сочетании с его высокой реакционной способностью означает, что с ацетилхлоридом в лаборатории следует обращаться с осторожностью. Это бесцветная дымящая жидкость с резким запахом, хорошо растворимая в полярных растворителях, таких как этанол и ацетон.
Температура плавления ацетилхлорида
C2H3ClO имеет температуру плавления -112,1°C (-169,8°F) при стандартном атмосферном давлении. Это делает его очень летучим и реакционноспособным соединением, требующим осторожного обращения и хранения.
Плотность ацетилхлорида г/мл
Ацетилхлорид имеет плотность 1,104 г/мл при 25°C (77°F). Это означает, что C2H3ClO плотнее воды и тонет в ней. Плотность C2H3ClO важна для определения того, сколько материала можно хранить в данном объеме, а также для принятия соответствующих мер безопасности, необходимых для обращения с материалом и его хранения.
Ацетилхлорид Молекулярный вес
Молекулярная масса C2H3ClO составляет 78,50 г/моль. Это значение важно для определения количества C2H3ClO, необходимого для химических реакций, а также для перевода между различными единицами измерения.
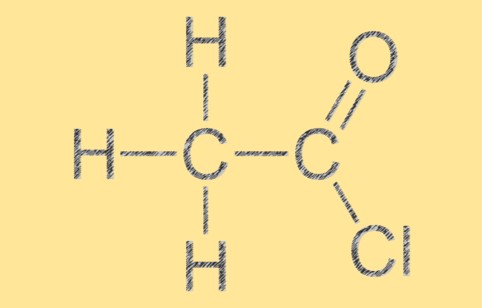
Структура ацетилхлорида
Ацетилхлорид имеет тригональную плоскую молекулярную геометрию с атомом углерода в центре, окруженным тремя другими атомами в плоском треугольном расположении. Молекула имеет двойную связь C=O между атомами углерода и кислорода и одинарную связь между атомами углерода и хлора. Молекулярная структура C2H3ClO придает ему характерную реакционную способность и химические свойства.
Формула ацетилхлорида
Химическая формула ацетилхлорида — C2H3ClO, которая отражает количество и тип атомов в молекуле. Формула важна для стехиометрических расчетов в химических реакциях и для идентификации соединения в лаборатории. C2H3ClO в основном используется в качестве реагента в органическом синтезе и как ацетилирующий агент при производстве фармацевтических препаратов и красителей.
| Появление | Бесцветная жидкость |
| Удельный вес | 1,104 г/мл при 25°C |
| Цвет | Бесцветный |
| Запах | Акко |
| Молярная масса | 78,50 г/моль |
| Плотность | 1,104 г/мл при 25°C |
| Точка плавления | -112,1°С |
| Точка кипения | 51,5°С |
| Мигающая точка | -26°С |
| Растворимость в воде | Бурно реагирует с водой |
| Растворимость | Растворим в большинстве органических растворителей. |
| Давление газа | 69,7 мм рт.ст. при 25°C |
| Плотность пара | 2,7 (воздух=1) |
| пКа | -6,3 |
| рН | Очень кислый |
Ацетилхлорид: безопасность и опасности
C2H3ClO — высокореактивное и опасное вещество, представляющее значительный риск для здоровья и безопасности человека. Это едкое и токсичное вещество, которое при воздействии может вызвать серьезные ожоги кожи, повреждение глаз и раздражение дыхательных путей. Ацетилхлорид также может бурно реагировать с водой с образованием соляной кислоты, которая раздражает дыхательные пути. Важно обращаться с C2H3ClO с особой осторожностью, носить соответствующие средства индивидуальной защиты и использовать его только в хорошо проветриваемом помещении. Правильное хранение, маркировка и транспортировка также необходимы для предотвращения несчастных случаев и обеспечения безопасного обращения с этим веществом.
| Символы опасности | Коррозионный, Токсичный |
| Описание безопасности | Не вдыхайте пары. Надевайте защитные перчатки и средства защиты глаз/лица. В случае пожара используйте углекислотный, сухой химический или пенный огнетушитель. |
| Идентификаторы сети | ООН1717 |
| код ТН ВЭД | 2915.90.9000 |
| Класс опасности | 8 |
| Группа упаковки | II |
| Токсичность | Очень токсично и коррозийно. Вызывает сильные ожоги кожи и глаз. Может быть смертельным при вдыхании или проглатывании. |
Методы синтеза ацетилхлорида
C2H3ClO получают взаимодействием уксусной кислоты с тионилхлоридом, трихлоридом фосфора или пентахлоридом фосфора. Эти методы предполагают использование высокореактивных и опасных реагентов, и их следует применять с особой осторожностью.
Наиболее распространенный метод синтеза C2H3ClO включает реакцию уксусной кислоты с тионилхлоридом. Этот метод обычно включает добавление тионилхлорида к уксусной кислоте контролируемым образом с тщательным контролем температуры во избежание перегрева и разложения. В результате реакции образуется C2H3ClO и газообразный диоксид серы в качестве побочного продукта.
Другой метод синтеза C2H3ClO включает реакцию уксусной кислоты с трихлоридом или пентахлоридом фосфора. В этом методе уксусную кислоту смешивают с трихлоридом фосфора или пентахлоридом фосфора и нагревают для инициирования реакции. В результате реакции образуется C2H3ClO и фосфорная кислота в качестве побочного продукта.
Важно отметить, что эти методы предполагают использование высокореактивных и опасных химических веществ и должны проводиться только опытными химиками в хорошо проветриваемом помещении с соответствующими средствами индивидуальной защиты. Кроме того, синтез C2H3ClO необходимо проводить под вытяжным шкафом, чтобы свести к минимуму воздействие токсичных и агрессивных газов.
Использование ацетилхлорида
Ацетилхлорид — универсальное химическое соединение, которое находит множество применений в промышленности и исследованиях. Некоторые из распространенных применений C2H3ClO:
- Производство фармацевтических препаратов. В синтезе различных фармацевтических продуктов, включая обезболивающие, антибиотики и анестетики, используется C2H3ClO.
- Производство красителей и отдушек. Производство различных красителей и отдушек, таких как кумарин, используемый в парфюмерии и мыле, предполагает использование C2H3ClO.
- Производство полимеров: Производство различных полимеров, таких как поликарбонат и поливинилхлорид, связанных C2H3ClO в качестве реагента.
- Производство ацетилированных производных: C2H3ClO играет решающую роль в производстве ацетилированных производных таких соединений, как аминокислоты и спирт.
- Химические реакции: C2H3ClO проявляет высокую реакционную способность, что делает его ценным реагентом в различных химических реакциях, включая реакции ацетилирования и реакции Фриделя-Крафтса.
- Лабораторные исследования: C2H3ClO часто применяется в лабораторных исследованиях в качестве реагента для химических реакций и растворителя различных соединений.
Важно отметить, что C2H3ClO является опасным веществом, и с ним следует обращаться с особой осторожностью. При использовании C2H3ClO следует соблюдать соответствующие протоколы и правила безопасности, чтобы свести к минимуму риски, связанные с его обращением и использованием.
