Zincato de sódio é um composto químico com a fórmula Na2Zn(OH)4. É um pó sólido branco utilizado como precursor na síntese de nanopartículas de óxido de zinco e como reagente em química orgânica.
| Nome IUPAC | Zincato de Sódio |
| Fórmula molecular | Na2Zn(OH)4 |
| Número CAS | 12179-14-5 |
| Sinônimos | Hidróxido de zinco e sódio, zincato de sódio, tetra-hidroxizincato dissódico, zinco, tetra-hidróxido |
| InChI | InChI=1S/2Na.O2Zn/c;;1-3-5-6-4-2/q2*+1;-2; |
Fórmula de zincato de sódio
A fórmula química do zincato de sódio é Na2Zn(OH)4, o que indica que ele contém dois íons de sódio (Na+) e um íon de óxido de zinco (ZnO2-). A fórmula é usada para representar a composição do composto e pode ser usada para calcular a massa molar, peso molecular e outras propriedades do composto. A fórmula também pode ser usada para escrever equações químicas e prever os produtos de reações envolvendo zincato de sódio.
Massa molar de Zincato de Sódio:
A massa molar do zincato de sódio é calculada somando as massas atômicas de todos os elementos presentes em um mol do composto. Para zincato de sódio (Na2Zn(OH)4), a massa molar é de aproximadamente 179,42 g/mol. Este valor pode ser útil na determinação da quantidade de zincato de sódio necessária para preparar uma quantidade específica de solução ou na determinação da massa do composto numa determinada amostra.
Ponto de ebulição do zincato de sódio:
Na2Zn(OH)4 é um composto sólido e não tem ponto de ebulição. No entanto, decompõe-se a altas temperaturas e os gases resultantes podem ter pontos de ebulição dependendo da sua composição. Portanto, o ponto de ebulição do Na2Zn(OH)4 não é uma propriedade relevante.
Densidade de Zincato de Sódio g/ml:
A densidade do Na2Zn(OH)4 é de aproximadamente 2,7 g/cm³. Este valor pode ser útil para determinar a massa de um volume específico de Na2Zn(OH)4 ou para determinar o volume de uma massa específica de zincato de sódio. A densidade depende da temperatura e pressão e pode variar dependendo das condições específicas do experimento.
Peso molecular do zincato de sódio:
O peso molecular de Na2Zn(OH)4 é calculado adicionando os pesos atômicos de todos os átomos da molécula. O zincato de sódio tem um peso molecular de aproximadamente 179,42 g/mol. O peso molecular é uma propriedade importante porque é utilizado em cálculos relacionados à quantidade de zincato de sódio necessária em uma reação ou formulação.
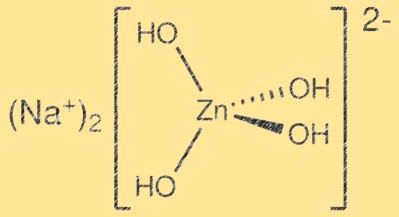
Estrutura do zincato de sódio:
Na2Zn(OH)4 possui uma estrutura cristalina complexa com camadas de tetraedros ZnO4 e octaedros Na2O6. Os tetraedros ZnO4 compartilham cantos para formar uma rede tridimensional, enquanto os octaedros Na2O6 ocupam os espaços intersticiais. A estrutura resultante é em camadas e pode ser descrita como um derivado da estrutura wurtzita. As camadas são mantidas unidas pelas forças de Van der Waals e a estrutura cristalina resultante é relativamente fraca.
| Aparência | Pó sólido branco |
| Gravidade Específica | 2,7g/cm³ |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 179,42 g/mol |
| Densidade | 2,7g/cm³ |
| Ponto de fusão | N / D |
| Ponto de ebulição | N / D |
| Ponto flash | N / D |
| Solubilidade em Água | Solúvel |
| Solubilidade | Solúvel em água, insolúvel em solventes orgânicos |
| Pressão de vapor | N / D |
| Densidade do vapor | N / D |
| pKa | N / D |
| pH | Alcalino (pH > 7) |
Observe que algumas propriedades, como ponto de fulgor e pressão de vapor, não são relevantes para o zincato de sódio porque é um composto sólido.
Segurança e perigos do zincato de sódio
O Na2Zn(OH)4 apresenta certos riscos de segurança e perigos que devem ser considerados ao manusear o composto. É importante usar equipamento de proteção individual adequado, como luvas e óculos de segurança, ao manusear Na2Zn(OH)4. O composto pode causar irritação na pele e nos olhos e a ingestão pode resultar em distúrbios gastrointestinais. O Na2Zn(OH)4 também pode apresentar risco de incêndio e deve ser armazenado em local fresco e seco, longe do calor e de fontes de ignição. O manuseio e armazenamento adequados de Na2Zn(OH)4 podem ajudar a minimizar os riscos associados ao composto.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | S22: Não respirar as poeiras. S24/25: Evitar contato com a pele e os olhos. S37/39: Usar luvas e proteção ocular/facial adequadas. |
| Números de identificação da ONU | Não aplicável |
| Código SH | 2834,29 |
| Classe de perigo | Não classificado como perigoso |
| Grupo de embalagem | Não aplicável |
| Toxicidade | A toxicidade exata do zincato de sódio não está bem caracterizada, mas pode causar irritação na pele e nos olhos e ser prejudicial se ingerido. É importante manusear o composto com cuidado e usar equipamento de proteção individual adequado. |
Métodos para a síntese de zincato de sódio
Existem vários métodos que você pode usar para sintetizar Na2Zn(OH)4, mas o método mais comum envolve a mistura de óxido de zinco e hidróxido de sódio em uma solução aquosa. Primeiro você precisa misturar óxido de zinco com hidróxido de sódio em uma solução aquosa. Em seguida, aqueça e mexa a mistura até formar uma solução transparente. Assim que a solução esfriar, o Na2Zn(OH)4 precipitará da solução, que deve ser lavada com água e seca para obter o produto final.
Outra forma de sintetizar Na2Zn(OH)4 é adicionar zinco a uma solução de hidróxido de sódio e aquecer a mistura até formar uma solução límpida. Assim que a solução esfriar, o Na2Zn(OH)4 precipitará da solução, que deve ser lavada com água e seca para obter o produto final.
É crucial realizar a síntese de Na2Zn(OH)4 em uma área bem ventilada e usar equipamento de proteção individual adequado. Também deve-se ter cuidado ao manusear o hidróxido de sódio, pois pode ser corrosivo e causar irritação na pele e nos olhos.
Usos do zincato de sódio
Várias indústrias usam Na2Zn(OH)4 para diversos fins. Uma de suas principais aplicações é como precursor da síntese do óxido de zinco, que os fabricantes utilizam na produção de borracha, cerâmica e outros produtos. O Na2Zn(OH)4 atua como estabilizador na produção de fibras sintéticas e plásticos.
Na indústria agrícola, os agricultores utilizam Na2Zn(OH)4 como fertilizante para fornecer às plantas nutrientes essenciais, como o zinco. Também pode proteger as plantações contra doenças fúngicas, servindo como fungicida.
Os fabricantes de pigmentos, como o amarelo de zinco, utilizam Na2Zn(OH)4 em sua produção, que é comumente utilizado em tintas e revestimentos. Além disso, as indústrias usam Na2Zn(OH)4 como inibidor de corrosão para proteger os metais da corrosão.
Na indústria farmacêutica, o Na2Zn(OH)4 serve como fonte de zinco, nutriente essencial para a saúde humana. O zinco é um elemento essencial em vários processos biológicos, desempenhando um papel essencial na manutenção de um sistema imunitário saudável e na promoção da cicatrização de feridas.
No geral, o Na2Zn(OH)4 tem uma gama de aplicações importantes em diversas indústrias e é um composto versátil com muitos usos potenciais.
Questões:
O zincato de sódio é um sal?
O zincato de sódio é considerado um sal porque forma um composto iônico através da reação de um metal (zinco) e uma base (hidróxido de sódio). As forças eletrostáticas mantêm juntos os íons de zinco com carga positiva e os íons de sódio e hidróxido com carga negativa. Os sais são compostos iônicos formados pela reação entre um ácido e uma base ou um metal e um não metal. Embora o Na2Zn(OH)4 não resulte da reação de um ácido e uma base, ele atende à definição geral de sal como um composto iônico.
