O trióxido de cromo, também conhecido como ácido crômico, é um composto inorgânico com a fórmula CrO3. É o anidrido ácido do ácido crômico e às vezes é comercializado com o mesmo nome.
| Nome IUPAC | Óxido de cromo (VI) |
| Fórmula molecular | CrO3 |
| Número CAS | 1333-82-0 |
| Sinônimos | Anidrido crômico, anidrido de óxido de cromo, trioxocromo Óxido de cromo (VI) |
| InChI | InChI=1S/Cr.3O |
Propriedades do trióxido de cromo
Fórmula de trióxido de cromo
A fórmula do anidrido crômico é CrO3. Consiste em um átomo de cromo ligado a três átomos de oxigênio.
Massa molar de trióxido de cromo
A massa molar do anidrido crômico é calculada somando as massas atômicas de seus elementos constituintes, que são o cromo (Cr) e o oxigênio (O). A massa molar é de aproximadamente 99,994 g/mol.
Ponto de ebulição do trióxido de cromo
O anidrido crômico não possui um ponto de ebulição distinto. Quando aquecido, ele se decompõe em óxido de cromo e gás oxigênio sem passar pela fase líquida.
Ponto de fusão do trióxido de cromo
O ponto de fusão do anidrido crômico é aproximadamente 196°C. Nessa temperatura, ele passa do estado sólido para o líquido.
Densidade de trióxido de cromo g/mL
A densidade do anidrido crômico é de aproximadamente 2,7 g/mL. Este valor representa a massa do composto por unidade de volume.
Peso molecular do trióxido de cromo
O peso molecular do anidrido crômico, também chamado de massa molar, é de aproximadamente 99,994 g/mol. É a soma das massas atômicas dos átomos de cromo e oxigênio no composto.
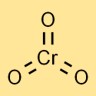
Estrutura do trióxido de cromo
O anidrido crômico tem uma estrutura molecular na qual um átomo de cromo está ligado centralmente a três átomos de oxigênio. Adota uma geometria tetraédrica, com o átomo de cromo no centro e os átomos de oxigênio nos cantos.
Solubilidade do trióxido de cromo
O anidrido crômico é altamente solúvel em água. Dissolve-se facilmente, formando uma solução de ácido crômico. A solubilidade do anidrido crômico em água permite sua utilização em diversos processos e aplicações químicas.
| Aparência | Cristais vermelho escuro |
| Gravidade Específica | 2,7 g/ml |
| Cor | Vermelho escuro |
| Cheiro | Inodoro |
| Massa molar | 99,994 g/mol |
| Densidade | 2,7 g/ml |
| Ponto de fusão | 196°C |
| Ponto de ebulição | Decomposto |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Muito solúvel |
| Solubilidade | Solúvel em vários solventes, como etanol, éter, etc. |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Ácido (em solução) |
Segurança e perigos do trióxido de cromo
O anidrido crômico apresenta riscos significativos à segurança e deve ser manuseado com cuidado. É uma substância altamente corrosiva e oxidante, capaz de causar queimaduras graves na pele, olhos e aparelho respiratório. A inalação ou ingestão de anidrido crômico pode causar dificuldade respiratória, problemas gastrointestinais e até danos a órgãos.
Equipamento de proteção individual (EPI) adequado deve ser usado ao trabalhar com anidrido crômico, incluindo luvas, óculos de proteção e respirador. Deve ser armazenado em local fresco e seco, longe de materiais incompatíveis e fontes de ignição.
O descarte do anidrido crômico deve ser realizado de acordo com a legislação local, pois é considerado um resíduo perigoso. Não deve ser liberado no meio ambiente.
| Símbolos de perigo | Corrosivo, Oxidante |
| Descrição de segurança | Evite contato com a pele, olhos e inalação. Utilize equipamento de proteção adequado. |
| Números de identificação da ONU | ONU 1463 |
| Código SH | 2819.90.90 |
| Classe de perigo | 5.1 (Agente oxidante) |
| Grupo de embalagem | II |
| Toxicidade | Muito tóxico |
Métodos de síntese de trióxido de cromo
Existem vários métodos para sintetizar o anidrido crômico.
Um método comum envolve a reação entre dicromato de sódio e ácido sulfúrico . Num ambiente controlado, alguém mistura dicromato de sódio (Na2Cr2O7) com ácido sulfúrico concentrado (H2SO4) . A reação resulta na formação de uma solução vermelha escura de anidrido crômico (CrO3) e sulfato de sódio (Na2SO4) como subproduto.
Outro método envolve a oxidação de compostos de cromo (III) utilizando agentes oxidantes fortes, como peróxido de hidrogênio (H2O2) ou ácido nítrico (HNO3) . Neste processo, misture o composto de cromo (III) com o agente oxidante sob condições específicas para converter o cromo (III) em anidrido crômico.
Prepare o anidrido crômico reagindo compostos metálicos de cromo ou cromo (II) com agentes oxidantes fortes, como permanganato de potássio (KMnO4) ou dicromato de potássio (K2Cr2O7). A reação leva à formação de anidrido crômico.
É importante observar que a síntese do anidrido crômico deve ser realizada com medidas de segurança adequadas e em conformidade com os regulamentos apropriados. Indivíduos experientes devem conduzir o processo de síntese em laboratórios bem equipados para garantir a sua segurança e minimizar os impactos ambientais.
Usos do trióxido de cromo
O anidrido crômico encontra aplicação como agente oxidante em diversos processos químicos, incluindo a produção de compostos orgânicos.
- Os fabricantes o utilizam para produzir corantes e pigmentos, como amarelo cromo e verde cromo.
- A indústria de galvanoplastia utiliza-o para depositar cromo em superfícies metálicas, proporcionando resistência à corrosão e um acabamento atraente.
- É utilizado na preparação de catalisadores de cromo para reações de polimerização na produção de plásticos e materiais sintéticos.
- Desempenha um papel na síntese de produtos farmacêuticos e intermediários orgânicos.
- Os tratamentos preservativos de madeira utilizam-na como fungicida e inseticida para proteger contra podridão e pragas.
- Os laboratórios o utilizam como reagente para diversos testes e análises químicas.
- A sua utilização na produção de vidros e cerâmicas especializadas realça cores e propriedades específicas.
- A indústria de curtumes utiliza-o para tratar couro, ajudando a estabilizar e tingir peles.
- É um componente na formulação de agentes de limpeza e tratamentos de superfície para superfícies metálicas.
É importante manusear o anidrido crômico com cautela devido à sua natureza tóxica e corrosiva. O cumprimento dos protocolos de segurança adequados garante a proteção das pessoas e do meio ambiente durante o seu uso e descarte.
Questões:
P: O que é CrO3?
R: CrO3 é anidrido crômico, um composto que consiste em um átomo de cromo ligado a três átomos de oxigênio.
P: O CrO3 é um agente oxidante forte?
R: Sim, o CrO3 é um poderoso agente oxidante comumente usado em reações químicas para facilitar a oxidação de vários compostos.
P: O que o CrO3 faz com o álcool?
R: O CrO3 pode oxidar álcoois e convertê-los nos compostos carbonílicos correspondentes, como aldeídos ou cetonas.
P: Que produto orgânico você obteria da reação do 1-pentanol com CrO3, H2O e H2SO4?
R: A reação produziria o produto orgânico 1-pentanona, que é uma cetona.
P: Qual a melhor escolha de reagente para realizar a seguinte transformação: PCC, HIO4, CrO3, NaOH?
R: A melhor escolha de reagente para esta transformação seria PCC (clorocromato de piridínio).
P: O CrO3 é anfotérico?
R: Não, o CrO3 não é anfotérico. É um composto muito ácido, mas incapaz de exibir propriedades básicas.
P: Como encontrar o número de oxidação do Cr no CrO3?
R: O número de oxidação do Cr no CrO3 é +6.
P: Qual é o nome do CrO3?
R: O nome do CrO3 é anidrido crômico.
P: O que o CrO3 faz com os álcoois não anônicos?
R: O CrO3 pode oxidar álcoois não anônicos, convertendo-os nos compostos carbonílicos correspondentes, como cetonas não anônicas.
P: Qual é a carga do cátion do metal de transição no CrO3?
R: O cátion do metal de transição no CrO3, que é o cromo, tem carga de +6.
