A trimetilamina (TMA) é um composto com forte odor de peixe. É encontrado em peixes, produtos de peixe em decomposição e suor humano. Isso pode causar mau hálito e odor corporal.
| Nome IUPAC | N,N-Dimetilmetanamina |
| Fórmula molecular | C3H9N |
| Número CAS | 75-50-3 |
| Sinônimos | TMA, dimetilamina, metildimetilamina, N,N-dimetilamina, metiamina terciária, metilamina terciária |
| InChI | InChI=1S/C3H9N/c1-4(2)3/h1-3H3 |
Propriedades da trimetilamina
Fórmula de trimetilamina
A fórmula química da trimetilamina é C3H9N, o que indica que a molécula contém três átomos de carbono, nove átomos de hidrogênio e um átomo de nitrogênio. A fórmula pode ser usada para calcular o peso molecular e outras propriedades da trimetilamina.
Massa molar de trimetilamina
A massa molar do TMA é 59,11 g/mol. Este valor é calculado somando as massas atômicas de todos os átomos presentes na molécula. A massa molar é um parâmetro importante utilizado em cálculos químicos, principalmente para determinar a estequiometria e o número de moles de uma substância.
Ponto de ebulição da trimetilamina
O ponto de ebulição do TMA é -6,9°C ou 19,6°F. Este é um ponto de ebulição relativamente baixo, o que significa que o composto é volátil e pode evaporar facilmente. O TMA pode ser liquefeito pela aplicação de pressão e é comumente usado na forma de gás em diversas aplicações.
Ponto de fusão da trimetilamina
O ponto de fusão do TMA é -117,3°C ou -179,1°F. Este é um ponto de fusão muito baixo, o que significa que o composto é geralmente encontrado no estado líquido ou gasoso à temperatura ambiente. Pode ser solidificado por resfriamento a temperaturas abaixo do seu ponto de fusão.
Densidade de trimetilamina g/mL
A densidade do TMA é 0,692 g/mL à temperatura ambiente. Este valor é usado para determinar a massa de TMA por unidade de volume. A densidade do composto é relativamente baixa em comparação com outros líquidos, tornando-o menos denso que a água.
Peso molecular da trimetilamina
O peso molecular do TMA é 59,11 g/mol. Este valor é a soma dos pesos atômicos de todos os átomos da molécula. O peso molecular é usado para calcular a quantidade de uma substância necessária para uma reação ou processo químico específico.
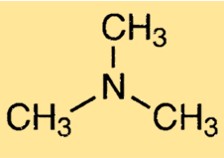
Estrutura da trimetilamina
O TMA possui uma geometria molecular piramidal, com formato de pirâmide trigonal ao redor do átomo de nitrogênio. A molécula possui um átomo de nitrogênio central ligado a três grupos metil. O átomo de nitrogênio possui um par de elétrons não ligantes, o que contribui para o odor característico da molécula.
Solubilidade da trimetilamina
O TMA é solúvel em água e solventes orgânicos, incluindo etanol, éter e acetona. A solubilidade do TMA em água é de 1,8 g/100 mL a 25°C. O composto é altamente solúvel em solventes polares devido à sua natureza polar, tornando-o útil em diversas aplicações industriais.
| Aparência | Gás incolor com forte odor de peixe |
| Gravidade Específica | 0,692 a 25°C |
| Cor | Incolor |
| Cheiro | Cheiro forte de peixe |
| Massa molar | 59,11 g/mol |
| Densidade | 0,692 g/ml a 25°C |
| Ponto de fusão | -117,3°C ou -179,1°F |
| Ponto de ebulição | -6,9°C ou 19,6°F |
| Ponto flash | -20ºC |
| Solubilidade em Água | Solúvel |
| Solubilidade | Solúvel em solventes orgânicos |
| Pressão de vapor | 542 mmHg a 20°C |
| Densidade do vapor | 2.1 a 25°C |
| pKa | 9,79 |
| pH | Alcalino |
Segurança e perigos da trimetilamina
O TMA apresenta vários riscos de segurança, principalmente devido à sua natureza altamente inflamável e ao forte odor de peixe. É classificado como substância perigosa por diversas agências reguladoras, incluindo a Agência de Proteção Ambiental dos Estados Unidos (EPA). A exposição ao TMA pode causar irritação na pele e nos olhos, problemas respiratórios e náuseas. Também é tóxico quando ingerido ou inalado em grandes quantidades. Devem ser tomadas precauções apropriadas ao manusear o TMA, incluindo o uso de equipamento de proteção adequado e a garantia de ventilação adequada. Se exposto, deve-se procurar atendimento médico imediato.
| Símbolos de perigo | Inflamável, Corrosivo |
| Descrição de segurança | Manter afastado do calor, faíscas e chamas abertas. Evite respirar gases. Para uso somente com ventilação adequada. Use equipamento de proteção adequado. |
| Números de identificação da ONU | UN1083 |
| Código SH | 29211900 |
| Classe de perigo | 2.1 – Gases inflamáveis |
| Grupo de embalagem | PG I |
| Toxicidade | Tóxico se ingerido ou inalado em grandes quantidades. Causa irritação na pele e nos olhos, problemas respiratórios e náuseas. |
Métodos para a síntese de trimetilamina
Existem vários métodos para sintetizar TMA, mas o mais comum é a reação do formaldeído com cloreto de amônio na presença de hidróxido de cálcio . Conhecemos esse processo como reação de Eschweiler-Clarke.
Outro método envolve a reação da dimetilamina com formaldeído , seguida de hidrogenação na presença de um catalisador. Chamamos esse método de reação de Leuckart-Wallach.
A reação de Frankland produz TMA quando hidróxido de sódio ou potássio está presente durante a reação da amônia com borato de trimetila.
O TMA pode ser produzido reagindo iodeto de metila com amônia e depois reduzindo-o com pó de zinco. Os químicos chamam esse método de degradação de Hofmann.
Outros métodos menos comuns de síntese de TMA incluem a reação de trimetil fosfito com amônia, a reação de óxido de TMA com ácido e a reação de trimetil alumínio com amônia .
No geral, a síntese de TMA requer um manuseio cuidadoso de produtos químicos reativos e potencialmente perigosos, bem como conhecimentos em química orgânica.
Usos da trimetilamina
O TMA tem diversos usos em diversas indústrias devido às suas propriedades químicas únicas, incluindo seu odor forte e distinto. Aqui estão alguns dos usos mais comuns do TMA:
- Fabricação de agrotóxicos: Utilizado na produção de diversos agrotóxicos, incluindo clorpirifós e diazinon.
- Síntese Orgânica: Os químicos orgânicos utilizam amplamente o TMA para sintetizar sais de amônio quaternário, que encontram amplas aplicações em diversas indústrias devido às suas propriedades excepcionais.
- Tratamento de gases: Usado para remover gases ácidos, como dióxido de carbono e sulfeto de hidrogênio, de gás natural e produtos petrolíferos.
- Indústria farmacêutica: utilizada na produção de diversos produtos farmacêuticos, incluindo o antidiabético metformina e o anestésico local procaína.
- Indústria alimentícia: O TMA causa o odor de peixe encontrado em alguns frutos do mar e adiciona sabor a alguns produtos alimentícios como agente aromatizante.
- Pesquisa laboratorial: Também utilizada em pesquisas laboratoriais, principalmente no estudo de estruturas proteicas.
Questões:
P: Qual é a fórmula química do ácido conjugado de base trimetilamina (CH3)3N?
R: A fórmula química do ácido conjugado do TMA é (CH3)3NH+.
Q: O pH da trimetilamina aquosa 0,050 M é 11,24. Qual é o KB desta base?
R: O Kb do TMA pode ser calculado usando o pH de sua solução, que é 11,24. O valor KB é 1,8 x 10^-5.
P: Qual é a concentração inicial de trimetilamina na água?
R: A concentração inicial de TMA na água depende da solução específica utilizada. Sem informações adicionais, é impossível determinar a concentração inicial.
P: A trimetilamina é uma base forte?
R: O TMA é uma base fraca porque se dissocia apenas parcialmente em solução aquosa.
P: A trimetilamina é polar?
R: Sim, o TMA é uma molécula polar devido à presença de um átomo de nitrogênio com um par de elétrons isolados e três grupos metil.
P: A trimetilamina é um ácido ou uma base?
R: O TMA é uma base porque aceita um próton de um ácido para formar seu ácido conjugado.
P: A trimetilamina causa corrosão sob tensão no aço carbono?
R: Sim, o TMA pode causar fissuras por corrosão sob tensão no aço carbono sob certas condições.
P: Para que é usada a trimetilamina em HPLC?
R: O TMA é usado como aditivo de fase móvel em HPLC para melhorar o formato do pico e a separação de compostos básicos.
P: Qual é a base mais forte, trimetilamina ou piridina?
R: A piridina é uma base mais forte que o TMA porque o átomo de nitrogênio faz parte de um anel aromático, que estabiliza o ácido conjugado resultante.
