O trifluoreto de nitrogênio ou NF3 é um potente gás de efeito estufa usado na indústria eletrônica para gravação e limpeza de plasma. Tem uma longa vida atmosférica e contribui para as mudanças climáticas.
| Nome IUPAC | Trifluoreto de nitrogênio |
| Fórmula molecular | NF3 |
| Número CAS | 7783-54-2 |
| Sinônimos | Trifluoramina, fluoreto de nitrogênio (NF3), fluoreto de nitrogênio (1:3), fluoreto de nitrogênio (NF3), fluoreto de nitrogênio (III), fluoreto de nitrogênio, comprimido, ONU 2451 |
| InChI | InChI=1S/F3N/c1-4(2)3 |
Massa molar de trifluoreto de nitrogênio
A massa molar do NF3 é 71,0 g/mol. Isso significa que um mol de NF3 contém 6.022 x 10 ^ 23 moléculas.
Ponto de ebulição do trifluoreto de nitrogênio
O NF3 tem um ponto de ebulição de -129,04°C ou -200,27°F. Isto é relativamente baixo em comparação com outros gases, tornando-o mais fácil de manusear em aplicações industriais.
Ponto de fusão do trifluoreto de nitrogênio
O trifluoreto de nitrogênio tem um ponto de fusão de -206,73°C ou -340,11°F. Isto significa que à temperatura ambiente, o NF3 está no estado gasoso.
Densidade de NF3 g/mL
A densidade do NF3 é 1,88 g/mL em temperatura e pressão padrão. Isso significa que o trifluoreto de nitrogênio é mais denso que o ar e irá afundar no solo se for liberado na atmosfera.
Peso molecular do trifluoreto de nitrogênio
O peso molecular do NF3 é 71,0 g/mol. É a soma dos pesos atômicos de nitrogênio e flúor no composto.
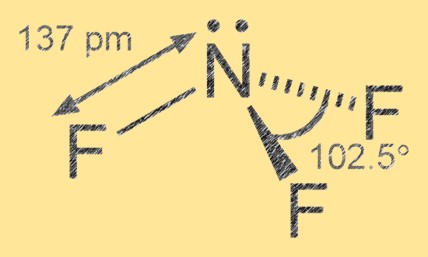
Estrutura do trifluoreto de nitrogênio
O trifluoreto de nitrogênio tem uma geometria molecular piramidal trigonal com nitrogênio como átomo central e três átomos de flúor ao seu redor. A ligação nitrogênio-flúor é covalente polar, com os átomos de flúor sendo mais eletronegativos que o nitrogênio, levando a uma carga parcial negativa nos átomos de flúor e a uma carga parcial positiva no átomo de nitrogênio.
Fórmula de trifluoreto de nitrogênio
A fórmula química do trifluoreto de nitrogênio é NF3, o que indica que uma molécula de NF3 contém um átomo de nitrogênio e três átomos de flúor.
| Aparência | Gás incolor |
| Gravidade Específica | 2,62 |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 71,0 g/mol |
| Densidade | 1,88 g/mL nas CNTP |
| Ponto de fusão | -206,73°C ou -340,11°F |
| Ponto de ebulição | -129,04°C ou -200,27°F |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 0,41 g/100 mL a 25°C |
| Solubilidade | Solúvel em solventes orgânicos |
| Pressão de vapor | 315kPa a 20°C |
| Densidade do vapor | 2,01 (ar = 1) |
| pKa | Não aplicável |
| pH | Não aplicável |
Segurança e perigos do trifluoreto de nitrogênio
O trifluoreto de nitrogênio (NF3) é geralmente considerado seguro se manuseado corretamente, mas pode representar vários perigos se manuseado incorretamente. Pode causar irritação na pele e nos olhos e a inalação de altas concentrações pode causar dificuldade respiratória. O gás NF3 pode deslocar o oxigênio em áreas mal ventiladas, levando à asfixia. É também um poderoso gás com efeito de estufa que contribui para as alterações climáticas. Em caso de incêndio, o NF3 pode liberar gás tóxico de fluoreto de hidrogênio. É essencial seguir protocolos de segurança adequados, incluindo ventilação adequada e uso de equipamentos de proteção, ao manusear NF3 para evitar esses perigos.
| Símbolos de perigo | T, C |
| Descrição de segurança | Evite a inalação e o contato com a pele e os olhos. Use apenas em áreas bem ventiladas. |
| Números de identificação da ONU | UN2451 |
| Código SH | 28129090 |
| Classe de perigo | 2.3 |
| Grupo de embalagem | II |
| Toxicidade | Muito tóxico |
Métodos para a síntese de trifluoreto de nitrogênio
Existem vários métodos para sintetizar trifluoreto de nitrogênio (NF3):
Um método comum envolve a reação de amônia anidra (NH3) com gás flúor (F2) na presença de um catalisador como ferro, níquel ou platina. A reação produz NF3 e fluoreto de hidrogênio (HF). As indústrias geralmente usam esse método para a produção de NF3.
Outro método envolve a decomposição térmica do fluoreto de amônio (NH4F) em altas temperaturas. A reação produz NF3 e gás amônia (NH3). A reação do NH3 com F2 é mais eficiente que este método, por isso é menos utilizado.
Outro método envolve a reação do óxido nítrico (NO) com gás flúor na presença de um catalisador. A reação produz gases NF3 e dióxido de nitrogênio (NO2).
O NF3 também pode ser sintetizado eletroquimicamente, passando uma descarga elétrica através de uma mistura de gases N2 e F2. O plasma resultante forma NF3 e outros compostos de nitrogênio-flúor.
Independentemente do método utilizado, é crucial manusear reagentes altamente reativos e potencialmente perigosos com precauções de segurança adequadas. Contudo, os pesquisadores devem controlar cuidadosamente o processo de síntese para garantir alto rendimento e pureza do produto final.
Usos do trifluoreto de nitrogênio
O trifluoreto de nitrogênio (NF3) possui diversas aplicações industriais devido às suas propriedades únicas.
- A indústria de semicondutores usa NF3 como agente de limpeza para pastilhas de silício. O NF3 também é utilizado na produção de monitores de tela plana, células solares e sistemas microeletromecânicos (MEMS).
- A fabricação de componentes eletrônicos usa NF3 como gás de gravação a plasma. Apresenta alta reatividade e remove seletivamente certos materiais, deixando outros intactos.
- Os sistemas de refrigeração também utilizam NF3 como refrigerante devido ao seu menor potencial de aquecimento global do que outros refrigerantes, tornando-o uma opção mais ecológica.
- A indústria aeroespacial utiliza o NF3 como propulsor devido ao seu alto impulso específico, o que permite a propulsão eficiente de naves espaciais.
Apesar dos seus muitos usos, existem preocupações sobre o impacto ambiental do NF3. É um poderoso gás de efeito estufa com longa vida útil na atmosfera. A produção e utilização de NF3 podem contribuir para as alterações climáticas se não forem tomadas as devidas precauções. É por isso que estão sendo feitos esforços para reduzir seu uso e desenvolver alternativas mais sustentáveis.
Questões:
P: O trifluoreto de nitrogênio (NF3) é polar?
R: Sim, NF3 é polar. Possui uma geometria molecular piramidal trigonal, com o átomo de nitrogênio no centro e três átomos de flúor dispostos ao seu redor. A forma assimétrica da molécula causa uma distribuição desigual da densidade eletrônica, resultando em uma molécula polar.
P: Qual é a fórmula do trifluoreto de nitrogênio?
R: A fórmula do trifluoreto de nitrogênio é NF3, o que indica que a molécula consiste em um átomo de nitrogênio e três átomos de flúor.
P: De onde vem o trifluoreto de nitrogênio?
R: O NF3 pode ser produzido por vários métodos, incluindo a reação de amônia anidra com gás flúor, decomposição térmica de fluoreto de amônio e síntese eletroquímica. É comumente usado na indústria de semicondutores como agente de limpeza e na fabricação de componentes eletrônicos e propulsores aeroespaciais.
P: Estrutura de Lewis do trifluoreto de nitrogênio?
R: A estrutura de Lewis para NF3 consiste em um átomo de nitrogênio ligado a três átomos de flúor por meio de ligações covalentes simples. Há também um par de elétrons não ligados no átomo de nitrogênio, dando à molécula uma forma de pirâmide trigonal.
P: Forças intermoleculares do trifluoreto de nitrogênio?
R: As forças intermoleculares do NF3 incluem interações dipolo-dipolo, que resultam da natureza polar da molécula. O molecular também experimenta as forças de dispersão de London, que são forças intermoleculares fracas resultantes de flutuações temporárias na densidade eletrônica.
P: O NF3 é polar ou apolar?
R: NF3 é polar devido à sua forma assimétrica e distribuição desigual de densidade eletrônica. A molécula possui momento dipolar, indicando que possui extremidade positiva e negativa, tornando-a uma molécula polar.
