O tricloreto de fósforo é um composto químico composto de fósforo e três átomos de cloro. É comumente usado como reagente em reações químicas e como precursor de compostos organofosforados.
| Nome IUPAC | Tricloreto de fósforo |
| Fórmula molecular | PCl3 |
| Número CAS | 7719-12-2 |
| Sinônimos | Triclorofosfina, cloreto de fósforo, tricloreto de fósforo, cloreto de fósforo (III) |
| InChI | InChI=1S/Cl3P/c1-4(2)3 |
Propriedades do tricloreto de fósforo
Fórmula de tricloreto de fósforo
A fórmula do tricloreto de fósforo é PCl3. Consiste em um átomo de fósforo ligado a três átomos de cloro. Este composto químico é amplamente utilizado em diversas indústrias e laboratórios por sua reatividade e versatilidade.
Massa molar de tricloreto de fósforo
A massa molar da triclorofosfina pode ser calculada somando as massas atômicas de seus elementos constituintes. O fósforo tem massa atômica de aproximadamente 31,0 gramas por mol, enquanto o cloro tem massa atômica de aproximadamente 35,5 gramas por mol. Portanto, a massa molar do PCl3 é de aproximadamente 137,3 gramas por mol.
Ponto de ebulição do tricloreto de fósforo
A triclorofosfina tem um ponto de ebulição de aproximadamente 76,1 graus Celsius. Isso significa que, quando aquecido, ele passa de líquido a gasoso. O ponto de ebulição é uma propriedade importante a ser considerada ao manusear e usar triclorofosfina em diversas reações e processos químicos.
Ponto de fusão de tricloreto de fósforo
O ponto de fusão da triclorofosfina é de aproximadamente -112,7 graus Celsius. Ele sofre uma transição de fase de sólido para líquido nesta temperatura. O ponto de fusão é uma característica crucial para determinar o estado físico da triclorofosfina sob diferentes condições.
Densidade de tricloreto de fósforo g/mL
A densidade da triclorofosfina é de aproximadamente 1,574 gramas por mililitro. A densidade representa a massa de uma substância por unidade de volume e fornece informações sobre a compactação e o peso do material. A densidade da triclorofosfina é frequentemente usada em cálculos e formulações químicas.
Peso molecular do tricloreto de fósforo
O peso molecular da triclorofosfina, calculado pela soma dos pesos atômicos de seus constituintes, é de aproximadamente 137,3 gramas por mol. O peso molecular é um parâmetro valioso para determinar a quantidade de substância em reações químicas e formular medições precisas.
Estrutura do tricloreto de fósforo
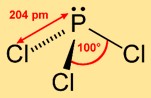
A triclorofosfina adota uma estrutura piramidal trigonal, onde o átomo de fósforo ocupa o ápice e os três átomos de cloro formam uma base triangular. Este arranjo molecular contribui para sua reatividade química e influencia seu comportamento em diversas reações.
Solubilidade do tricloreto de fósforo
A triclorofosfina é pouco solúvel em água, mas se dissolve facilmente em solventes orgânicos como benzeno e tetracloreto de carbono. As propriedades de solubilidade da triclorofosfina são considerações essenciais na determinação de solventes adequados para seu uso em diferentes processos e aplicações químicas.
| Aparência | Líquido incolor ou amarelo pálido |
| Gravidade Específica | 1.574g/mL |
| Cor | Incolor |
| Cheiro | Acre |
| Massa molar | 137,3 g/mol |
| Densidade | 1.574g/mL |
| Ponto de fusão | -112,7ºC |
| Ponto de ebulição | 76,1ºC |
| Ponto flash | Não aplicável (não inflamável) |
| Solubilidade em Água | Reage com água |
| Solubilidade | Solúvel em solventes orgânicos como benzeno e tetracloreto de carbono |
| Pressão de vapor | 105 mmHg a 25°C |
| Densidade do vapor | 4,83 (Ar = 1) |
| pKa | Não aplicável |
| pH | Ácido (pH <7) |
Segurança e perigos do tricloreto de fósforo
A triclorofosfina apresenta vários riscos de segurança e deve ser manuseada com cautela. É muito corrosivo para a pele, olhos e sistema respiratório. O contato direto pode causar queimaduras graves e lesões oculares. A inalação de seus vapores pode causar irritação respiratória e danos aos pulmões. Além disso, a triclorofosfina reage violentamente com a água, liberando vapores tóxicos de ácido clorídrico. É inflamável sob certas condições e o contato com agentes oxidantes pode causar incêndios ou explosões. Equipamentos de proteção individual adequados, como luvas, óculos de proteção e respirador, devem ser usados ao trabalhar com este produto químico. Ventilação adequada e armazenamento longe de substâncias incompatíveis são essenciais para minimizar os riscos.
| Símbolos de perigo | Corrosivo, Tóxico |
| Descrição de segurança | – Causa queimaduras na pele e lesões oculares graves – Nocivo se ingerido, inalado ou absorvido – Reage violentamente com a água, emitindo vapores tóxicos – Inflamável sob certas condições |
| Identificadores das Nações Unidas | ONU1809 |
| Código SH | 2812.10.00 |
| Classe de perigo | 8 (Corrosivo), 6,1 (Tóxico) |
| Grupo de embalagem | II |
| Toxicidade | Muito tóxico |
Métodos de síntese de tricloreto de fósforo
Vários métodos sintetizam triclorofosfina. Uma abordagem comum é aquecer o fósforo com excesso de cloro gasoso, levando à formação de triclorofosfina.
Outro método envolve o aquecimento de pentacloreto de fósforo (PCl5) com triclorofosfina (PCl3) para produzir triclorofosfina.
A reação entre o óxido de fósforo (P2O5) e o ácido clorídrico (HCl) combina as duas substâncias, geralmente com um condensador de refluxo, para facilitar a síntese da triclorofosfina.
Além disso, o aquecimento do tribrometo de fósforo (PBr3) com triclorofosfina resulta na produção de triclorofosfina.
É importante ressaltar que a síntese da triclorofosfina deve ser realizada com os devidos cuidados de segurança, pois envolve o manuseio de substâncias reativas e perigosas. Garanta a segurança durante o processo de síntese, empregando equipamentos de proteção adequados e mantendo condições de laboratório bem ventiladas.
No geral, estes diferentes métodos sintéticos oferecem diferentes abordagens para a obtenção de triclorofosfina, proporcionando assim flexibilidade na sua produção para uma ampla gama de aplicações industriais e de pesquisa.
Usos do tricloreto de fósforo
A triclorofosfina é amplamente utilizada em diversas aplicações devido à sua natureza versátil e reatividade. Aqui estão alguns usos principais:
- Reagente químico: Serve como importante reagente na síntese orgânica, principalmente na produção de compostos organofosforados. Participa de reações como a reação de Vilsmeier-Haack e a reação de Pudovik.
- Catalisador: A triclorofosfina atua como catalisador em diversas reações químicas, incluindo a síntese de produtos farmacêuticos, corantes e pesticidas.
- Fonte de fósforo: Serve como fonte de fósforo na produção de produtos químicos à base de fósforo, como ácido fosforoso e oxicloreto de fósforo.
- Retardador de chama: Os fabricantes adicionam triclorofosfina como retardador de chama aos polímeros, ajudando a reduzir a inflamabilidade e a melhorar a segurança contra incêndio dos materiais.
- Intermediário químico: Vários produtos químicos, incluindo produtos farmacêuticos, herbicidas, inseticidas e plastificantes, são produzidos usando triclorofosfina como intermediário crucial.
- Reagente de Laboratório: Os laboratórios utilizam amplamente a triclorofosfina como um reagente versátil para reações químicas, incluindo a formação de cloretos de acila e a conversão de álcoois em cloretos de alquila.
- Tratamento de Água: As fortes propriedades oxidantes e clorantes da triclorofosfina tornam-na um componente valioso nos processos de tratamento de água, removendo eficazmente impurezas e contaminantes.
- Produtos farmacêuticos: A triclorofosfina desempenha um papel na síntese de compostos farmacêuticos, incluindo medicamentos para tratar câncer, inflamação e distúrbios neurológicos.
- Aplicações agrícolas: Encontra aplicações na agricultura como componente de certos pesticidas e herbicidas, contribuindo assim para a proteção de culturas e controle de ervas daninhas.
- Fabricação de plásticos: Os fabricantes usam triclorofosfina na produção de plásticos e aditivos de polímeros para melhorar as propriedades dos materiais e torná-los retardadores de chama.
Estas diversas aplicações destacam a importância da triclorofosfina em diversas indústrias, pesquisas e aplicações diárias.
Questões:
P: O tricloreto de fósforo é uma base ou um ácido?
R: A triclorofosfina é um ácido.
P: Quantos átomos de cloro existem em uma molécula de tricloreto de fósforo, PCl3?
R: Existem três átomos de cloro em uma molécula de triclorofosfina.
P: Qual é o rendimento percentual de uma reação na qual reagem 200 g de tricloreto de fósforo?
R: O percentual de rendimento não pode ser determinado sem informações sobre a quantidade de produto obtido.
P: Quantos moles existem em 15 gramas de tricloreto de fósforo?
R: Existem aproximadamente 0,116 moles de triclorofosfina em 15 gramas.
P: Qual fórmula representa o composto molecular binário tricloreto de fósforo?
R: A fórmula PCl3 significa triclorofosfina.
P: Qual é a fórmula do tricloreto de fósforo?
R: A fórmula do tricloreto de fósforo é PCl3.
P: O tricloreto de fósforo é iônico ou covalente?
R: A triclorofosfina é um composto covalente.
P: Quantos átomos de cloro existem em uma molécula de tricloreto de fósforo, PCl3?
R: Existem três átomos de cloro em uma molécula de triclorofosfina.
P: Estrutura de Lewis da triclorofosfina?
R: A estrutura de Lewis da triclorofosfina tem um átomo central de fósforo ligado a três átomos de cloro, com pares solitários no átomo de fósforo.
P: Fósforo (P4) (s) + Cloro (g) → Triclorofosfina (l)?
R: A equação balanceada representa a reação entre o fósforo sólido (P4) e o cloro gasoso (Cl2) para formar PCl3 líquido.
P: Qual é a forma do tricloreto de fósforo?
R: A triclorofosfina tem formato de pirâmide trigonal devido à presença de um par de elétrons livres no átomo de fósforo.
P: O tricloreto de fósforo é um composto iônico?
R: Não, a triclorofosfina não é um composto iônico; é um composto covalente.
P: O tricloreto de fósforo possui planos de reflexão?
R: Não, a triclorofosfina não possui planos de reflexão.
