O tiossulfato de potássio (K2S2O3) é um composto químico utilizado em fotografia, como agente redutor e para neutralizar o cloro em piscinas. Tem uma aparência cristalina branca e é solúvel em água.
| Nome IUPAC | Tiossulfato de potássio |
| Fórmula molecular | K2S2O3 |
| Número CAS | 10294-66-3 |
| Sinônimos | Hipossulfito de potássio, tiossulfato de potássio, tiossulfato de potássio pentahidratado, tiossulfato de potássio pentahidratado, sulfurotioato de potássio, ácido sulfurotioico de potássio |
| InChI | InChI=1S/2K.H2O3S2/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
Propriedades do tiossulfato de potássio
Fórmula de tiossulfato de potássio
A fórmula química do tiossulfato de potássio (K2S2O3) indica o número e tipo de átomos presentes no composto. A fórmula consiste em dois átomos de potássio, dois átomos de enxofre e três átomos de oxigênio. Os átomos de potássio têm carga positiva, enquanto os átomos de enxofre e oxigênio têm carga negativa.
Massa molar de Tiossulfato de Potássio
A massa molar de K2S2O3 é 190,33 g/mol. Massa molar é a massa de um mol de uma substância e é calculada somando as massas atômicas de todos os átomos da fórmula química. No caso do K2S2O3, a fórmula consiste em dois átomos de potássio, dois átomos de enxofre e três átomos de oxigênio.
Ponto de ebulição do tiossulfato de potássio
K2S2O3 não tem ponto de ebulição porque se decompõe antes de atingir seu ponto de ebulição. A decomposição ocorre quando a temperatura atinge cerca de 100°C e é liberado dióxido de enxofre. Portanto, o composto geralmente não é usado em aplicações de alta temperatura.
Ponto de fusão do tiossulfato de potássio
O ponto de fusão do K2S2O3 é 48,3°C. Esta temperatura é relativamente baixa em comparação com outros compostos químicos. Quando aquecido a esta temperatura, o K2S2O3 sólido se tornará líquido.
Densidade de tiossulfato de potássio g/mL
A densidade do K2S2O3 é 1,667 g/mL. A densidade é uma medida da quantidade de massa contida em um determinado volume. Este valor significa que um mililitro de K2S2O3 tem massa de 1,667 gramas.
Peso Molecular de Tiossulfato de Potássio
O peso molecular do K2S2O3 é 190,33 g/mol. O peso molecular é a soma dos pesos atômicos de todos os átomos do composto. Muitas vezes é usado para converter moles e gramas de uma substância.
Estrutura do tiossulfato de potássio
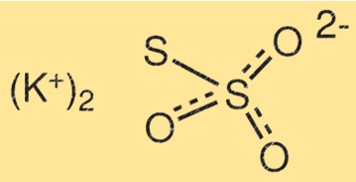
A estrutura do K2S2O3 consiste em dois átomos de potássio, dois átomos de enxofre e três átomos de oxigênio. Os átomos de enxofre estão unidos entre si por uma ligação dupla, enquanto o outro átomo de enxofre está ligado a um dos átomos de oxigênio. Os átomos de potássio estão ligados aos átomos de oxigênio restantes.
Solubilidade do tiossulfato de potássio
K2S2O3 é altamente solúvel em água, com solubilidade de 432 g/L a 20°C. Isso o torna um composto eficaz para tratamento de água e como agente fixador fotográfico. No entanto, não é solúvel em solventes orgânicos como etanol ou acetona.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 1.667 |
| Cor | Incolor a branco |
| Cheiro | Inodoro |
| Massa molar | 190,33 g/mol |
| Densidade | 1.667g/mL |
| Ponto de fusão | 48,3ºC |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Muito solúvel (432 g/L a 20°C) |
| Solubilidade | Insolúvel em solventes orgânicos |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | 6,0 – 9,0 (solução aquosa a 5%) |
Segurança e perigos do tiossulfato de potássio
O K2S2O3 é geralmente considerado seguro para manusear e usar quando as devidas precauções são tomadas. No entanto, é importante estar ciente de alguns perigos potenciais associados a este composto. A exposição ao pó ou vapor de K2S2O3 pode causar irritação nos olhos, pele e sistema respiratório. A ingestão do composto também pode causar náuseas, vômitos e diarreia. Além disso, o contato com o composto pode causar dermatite ou sensibilização cutânea em algumas pessoas. Tal como acontece com qualquer produto químico, é importante seguir os protocolos de segurança adequados ao manusear o K2S2O3 para evitar a exposição e reduzir o risco de acidentes.
| Símbolos de perigo | XI |
| Descrição de segurança | S22 – Não respirar as poeiras. S24/25 – Evitar contato com pele e olhos. S37/39 – Usar luvas e proteção ocular/facial adequadas. |
| Números de identificação da ONU | ONU 3077 |
| Código SH | 2832.10.00 |
| Classe de perigo | 9 – Materiais perigosos diversos |
| Grupo de embalagem | III |
| Toxicidade | LD50 (oral, rato): 2.500 mg/kg |
Métodos para a síntese de tiossulfato de potássio
O K2S2O3 pode ser sintetizado por vários métodos, incluindo a reação do enxofre com sulfito de potássio na presença de um hidróxido de metal alcalino.
Outro método envolve a reação do hidróxido de potássio com enxofre e dióxido de enxofre gasoso. Esta reação produz K2S2O3 e sulfato de potássio como subprodutos.
Um método de síntese alternativo envolve a reação de sulfito de potássio com tiossulfato de sódio em solução aquosa. O precipitado resultante pode ser filtrado e lavado para obter K2S2O3 puro.
Para preparar K2S2O3 em laboratório, pode-se reagir hidróxido de potássio com enxofre e, em seguida, adicionar gás dióxido de enxofre à mistura. O produto resultante é um sólido cristalino branco que pode ser posteriormente purificado por recristalização.
Usos do tiossulfato de potássio
K2S2O3 tem vários usos importantes em diversas indústrias. Aqui estão algumas de suas aplicações mais comuns:
- Fotografia: O tiossulfato de potássio é usado como agente fixador no processamento fotográfico para remover haletos de prata não utilizados e evitar o desbotamento da imagem.
- Agricultura: O tiossulfato de potássio é usado como fertilizante para fornecer enxofre e potássio às plantas, que são nutrientes importantes para o crescimento e desenvolvimento.
- Tratamento de Água: O tiossulfato de potássio é usado para remover o cloro da água de piscinas e spas, bem como para neutralizar os efeitos do cloro no tratamento de águas residuais industriais.
- Química Analítica: O tiossulfato de potássio é usado em química analítica como agente redutor para determinar a concentração de iodo e outros agentes oxidantes.
- Tratamentos Médicos: O tiossulfato de potássio tem sido usado em alguns tratamentos médicos, como o tratamento de envenenamento por cianeto.
- Aplicações Industriais: O tiossulfato de potássio é utilizado em diversas aplicações industriais, como galvanoplastia, curtimento de couro e extração de petróleo.
Questões:
P: Como você determina se algo é um agente redutor de tiossulfato de potássio?
R: K2S2O3 é um agente redutor porque tem a capacidade de doar elétrons para outras moléculas ou íons, reduzindo seu estado de oxidação.
P: O que torna o tiossulfato de potássio um agente redutor?
R: O K2S2O3 possui um átomo de enxofre com estado de oxidação inferior ao do sulfato, o que lhe permite doar elétrons para outras moléculas ou íons e atuar como agente redutor.
P: O tiossulfato de potássio queima vegetais verdes?
R: Não, o K2S2O3 não queima verduras. É um sólido cristalino branco e não apresenta coloração verde.
P: Qual é a solubilidade molar de AgCl em 1,0 M K2S2O3?
R: A solubilidade molar do AgCl em K2S2O3 1,0 M depende de vários fatores, como temperatura e força iônica. Um valor preciso não pode ser determinado sem informações adicionais.
P: Qual é a carga ou número de oxidação de K em 2 (K2S2O3)?
R: A carga ou número de oxidação de K em 2 (K2S2O3) é +1.
P: Qual é o estado de oxidação do S em K2S2O3?
R: O estado de oxidação de S em K2S2O3 é +2.
P: Quantas moléculas existem em 4 moles de K2S2O3?
R: Existem aproximadamente 4 x 6,022 x 10 ^ 23 moléculas de K2S2O3 em 4 moles de K2S2O3, o que equivale a 2,409 x 10 ^ 24 moléculas.
P: Quanto custam 4 moles de K2S2O3?
R: A massa de 4 moles de K2S2O3 pode ser calculada multiplicando a massa molar de K2S2O3 (190,31 g/mol) por 4, o que equivale a 761,24 gramas. Portanto, 4 moles de K2S2O3 equivalem a 761,24 gramas.
