O tiossulfato de cálcio (CaO3S2) é um composto composto por cálcio, oxigênio e enxofre. É comumente usado nas indústrias médica e agrícola como fertilizante e como tratamento para certas condições médicas.
| Nome IUPAC | Tiossulfato de cálcio |
| Fórmula molecular | CaO3S2 |
| Número CAS | 10124-41-1 |
| Sinônimos | Hipossulfito de cálcio; Tiossulfato de cálcio; Sulfidrato de cálcio; Tiossulfonato de cálcio |
| InChI | InChI=1S/Ca.H2O3S2/c;1-4(2)3/h;(H2,1,2,3)/q+2;/p-2 |
Propriedades do tiossulfato de cálcio
Fórmula de tiossulfato de cálcio
A fórmula química do tiossulfato de cálcio é CaS2O3. Indica o tipo e o número de átomos em uma molécula. A fórmula pode ser usada para determinar a massa molar e outras propriedades do composto.
Massa molar de tiossulfato de cálcio
A massa molar do CaO3S2 é 152,18 g/mol. É composto por um átomo de cálcio, três átomos de oxigênio e dois átomos de enxofre. A massa molar é uma propriedade importante usada em cálculos químicos, por exemplo, para determinar quanto de uma substância é necessária para produzir uma determinada reação.
Ponto de ebulição do tiossulfato de cálcio
O CaO3S2 não tem ponto de ebulição definido porque se decompõe antes de ser fervido. Começa a se decompor por volta de 75°C e libera dióxido de enxofre. O ponto de ebulição de uma substância é a temperatura na qual ela passa de líquido para gás a uma certa pressão.
Ponto de fusão de tiossulfato de cálcio
O ponto de fusão do CaO3S2 é 155°C. A esta temperatura, o composto sólido muda de sólido para líquido. O ponto de fusão é uma propriedade importante usada para identificar e classificar substâncias.
Densidade de tiossulfato de cálcio g/mL
A densidade do CaO3S2 é 2,67 g/mL. Densidade é a quantidade de massa por unidade de volume. A densidade de uma substância pode ser usada para determinar se ela flutuará ou afundará em outra substância, como a água.
Peso Molecular de Tiossulfato de Cálcio
O peso molecular do CaO3S2 é 152,18 g/mol. É a soma dos pesos atômicos de todos os átomos de uma molécula. O peso molecular é usado para calcular várias propriedades de uma substância, como sua molaridade ou concentração.
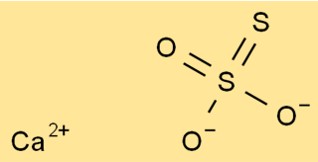
Estrutura do tiossulfato de cálcio
A estrutura do CaO3S2 é composta por um íon Ca2+ e um íon S2O32-. O íon tiossulfato possui um átomo de enxofre central ao qual estão ligados quatro átomos de oxigênio. Dois dos átomos de oxigênio têm ligação dupla e dois têm ligação simples.
Solubilidade do tiossulfato de cálcio
O CaO3S2 é ligeiramente solúvel em água, com solubilidade de aproximadamente 16 g/L à temperatura ambiente. É mais solúvel em água quente do que em água fria. Solubilidade é a quantidade máxima de uma substância que pode se dissolver em um determinado solvente a uma temperatura e pressão específicas.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 2,67g/ml |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 152,18 g/mol |
| Densidade | 2,67g/ml |
| Ponto de fusão | 155ºC |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 16 g/L à temperatura ambiente |
| Solubilidade | Ligeiramente solúvel em água |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | 7.2 (dissociação de ácido tiossulfúrico) |
| pH | 6,0-8,5 (solução aquosa a 1%) |
Segurança e perigos do tiossulfato de cálcio
O CaO3S2 é geralmente considerado seguro quando manuseado e usado adequadamente. No entanto, pode causar irritação na pele e nos olhos e dificuldade respiratória se inalado. Também pode causar irritação gastrointestinal se ingerido. Ao manusear este composto, é importante usar equipamento de proteção individual adequado, como luvas e proteção para os olhos. Em caso de contato com a pele, deve-se lavar com água em abundância. Em caso de contato com os olhos, enxaguar com água por pelo menos 15 minutos. Se ingerido ou inalado, procure atendimento médico imediatamente. O CaO3S2 deve ser armazenado em local fresco, seco e bem ventilado, longe de materiais incompatíveis.
| Símbolos de perigo | Xi (irritante) |
| Descrição de segurança | Evite respirar poeiras/fumos/gases/névoas/vapores/aerossóis. Use luvas de proteção/roupas de proteção/proteção ocular/proteção facial. |
| Números de identificação da ONU | Não regulamentado |
| Código SH | 2832.10.00 |
| Classe de perigo | 6.1 (tóxico) |
| Grupo de embalagem | III |
| Toxicidade | LD50 (oral, rato) 1064 mg/kg; LC50 (inalação, rato) >2.000 mg/m3 |
Métodos para a síntese de tiossulfato de cálcio
Existem vários métodos para sintetizar CaO3S2.
Um método envolve a reação de hidróxido de cálcio (Ca(OH)2) com Na2S2O3 em água para produzir CaO3S2 e hidróxido de sódio (NaOH).
Outro método é reagir sulfato de cálcio (CaSO4) com sulfito de sódio (Na2SO3) e enxofre (S) em água para produzir CaO3S2 e sulfato de sódio (Na2SO4).
O CaO3S2 pode ser obtido pela reação do enxofre (S) e do oxigênio (O2) com óxido de cálcio (CaO) ou carbonato de cálcio (CaCO3) em água. Este método produz CaO3S2, sulfato de cálcio (CaSO4) e dióxido de carbono (CO2) como subprodutos.
Para sintetizar CaO3S2, Na2S2O3 pode reagir com cloreto de cálcio (CaCl2) em água. Este método produz CaO3S2 e cloreto de sódio (NaCl) como subprodutos.
Outro método envolve a reação de hidróxido de cálcio (Ca(OH)2) com dióxido de enxofre (SO2) e oxigênio (O2) em água para produzir CaO3S2 e sulfito de cálcio (CaSO3) como subprodutos.
Usos do tiossulfato de cálcio
O CaO3S2 tem vários usos em diferentes indústrias. Alguns de seus usos incluem:
- Agricultura – Usado como fertilizante para fornecer cálcio e enxofre às plantas.
- Fotografia – Usado como agente fixador no processamento fotográfico para remover o excesso de haleto de prata de impressões e negativos.
- Tratamento de Água – Usado para remover o cloro da água e neutralizar o cloro nas águas residuais.
- Remédio – Usado como tratamento para envenenamento por cianeto porque reage com o cianeto para formar o tiocianato menos tóxico.
- Industrial – Utilizado em diversos processos industriais, como fabricação de celulose e papel, refino de petróleo e processamento têxtil.
- Indústria Alimentar – Usado como conservante de alimentos para prevenir o crescimento de bactérias e manter a frescura dos alimentos.
- Saúde Animal – Usado como suplemento nutricional para animais, fornecendo-lhes cálcio e enxofre.
- Cosméticos – Utilizado em cosméticos como agente condicionador de cabelo e hidratante para a pele.
Questões:
P: O que é mais solúvel em água, tiossulfato de cálcio ou tiossulfato de estrôncio?
R: O CaO3S2 é mais solúvel em água do que o tiossulfato de estrôncio.
P: O que você acha que seria mais solúvel em água, tiossulfato de estrôncio ou tiossulfato de cálcio?
R: O CaO3S2 deve ser mais solúvel em água do que o tiossulfato de estrôncio.
P: O que constitui um átomo de decloração de tiossulfato de cálcio?
R: Um átomo de decloração de CaO3S2 consiste em um átomo de cálcio, três átomos de oxigênio, dois átomos de enxofre e dois íons tiossulfato.
P: Como identificar o tiossulfato de cálcio?
R: O CaO3S2 pode ser identificado através de suas propriedades físicas e químicas, bem como através de diversas técnicas analíticas, como espectroscopia infravermelha e difração de raios X.
P: O que significam os números do tiossulfato de cálcio?
R: Os números em CaO3S2 referem-se ao número de átomos de cada elemento presente no composto. Por exemplo, CaO3S2 indica que existe um átomo de cálcio, três átomos de oxigênio e dois átomos de enxofre.
P: O que é tratamento de água com tiossulfato de cálcio?
R: O CaO3S2 é usado no tratamento de água para remover o cloro da água e neutralizar o cloro nas águas residuais.
P: Existem comprimidos de tiossulfato de cálcio?
R: Sim, os comprimidos de CaO3S2 estão disponíveis como suplemento nutricional para animais, fornecendo-lhes cálcio e enxofre.
