Tetrafluoroetileno ou C2F4 é um gás incolor e inodoro utilizado na produção de fluoropolímeros como o Teflon. Também é utilizado na produção de refrigerantes e propelentes.
| Nome da IUPAC | Tetrafluoroetileno |
| Fórmula molecular | C2F4 |
| Número CAS | 116-14-3 |
| Sinônimos | TFE, perfluoroetileno, eteno, tetrafluoro-, F4E, freon 1113, halocarbono 1113 |
| InChI | InChI=1S/C2F4/c3-1(4)2(5)6 |
Estrutura de Lewis C2F4
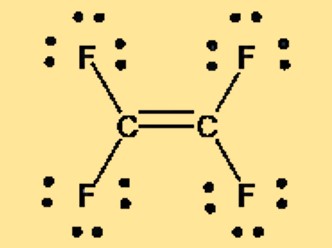
A estrutura de Lewis do tetrafluoroetileno, também conhecida como TFE ou C2F4, pode ser representada por dois átomos de carbono duplamente ligados entre si, com cada átomo de carbono ligado a dois átomos de flúor. A estrutura de Lewis mostra o arranjo dos elétrons de valência na molécula e fornece informações sobre a ligação e a geometria da molécula. A natureza apolar do TFE também é evidente em sua estrutura de Lewis, que não apresenta separação de carga ou momento dipolar líquido.
Massa molar de tetrafluoroetileno
A massa molar do tetrafluoroetileno, também chamado de TFE ou C2F4, é 100,02 g/mol. Esse valor é calculado somando as massas atômicas de todos os elementos presentes na molécula, que são dois átomos de carbono e quatro átomos de flúor. A massa molar é um parâmetro importante na determinação da quantidade de uma substância presente em um determinado volume ou massa e também é utilizada em cálculos estequiométricos.
Ponto de ebulição do tetrafluoroetileno
O tetrafluoroetileno tem um ponto de ebulição de -76,3°C (-105,34°F) à pressão padrão. É um gás muito volátil que pode vaporizar rapidamente à temperatura ambiente e à pressão atmosférica. O baixo ponto de ebulição do TFE o torna ideal para diversas aplicações industriais, como em sistemas de refrigeração e como propelente para aerossóis.
Ponto de fusão do tetrafluoroetileno
O tetrafluoroetileno não possui um ponto de fusão distinto porque sofre uma transição de fase diretamente do sólido para o gasoso, pulando a fase líquida. No entanto, a forma sólida do TFE pode existir a temperaturas inferiores a -76,3°C sob condições de alta pressão. A forma sólida do TFE também é muito instável e reativa e pode polimerizar ou decompor-se espontaneamente.
Densidade de tetrafluoroetileno g/ml
A densidade do tetrafluoroetileno à temperatura e pressão padrão (STP) é 1,47 g/L. No entanto, como o TFE é um gás, a sua densidade pode variar significativamente com as mudanças de temperatura e pressão. À temperatura ambiente e à pressão atmosférica, a densidade do TFE é de aproximadamente 3,21 g/L.
Peso molecular do tetrafluoroetileno
O peso molecular do C2F4 é 100,02 g/mol. Este valor é calculado somando os pesos atômicos de todos os átomos presentes na molécula. O TFE tem um peso molecular relativamente baixo, o que contribui para a sua elevada volatilidade e baixo ponto de ebulição.
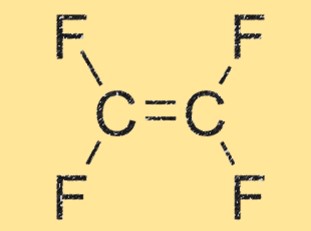
Estrutura C2F4
C2F4 tem uma estrutura linear, com dois átomos de carbono duplamente ligados entre si e cada um ligado a dois átomos de flúor. A molécula é altamente simétrica e não possui momento dipolar líquido, o que a torna apolar. A geometria linear do TFE também contribui para sua alta reatividade e capacidade de formar cadeias poliméricas.
Fórmula C2F4
A fórmula química do C2F4 é C2F4, o que indica que a molécula contém dois átomos de carbono e quatro átomos de flúor. A fórmula fornece informações sobre os tipos e números de átomos presentes na molécula, o que pode ser útil na previsão de seu comportamento e reações químicas.
| Aparência | Gás incolor |
| Gravidade Específica | 1,47 g/L nas CNTP |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 100,02 g/mol |
| Densidade | 3,21 g/L à temperatura ambiente e pressão atmosférica |
| Ponto de fusão | Não tem um ponto de fusão distinto |
| Ponto de ebulição | -76,3°C (-105,34°F) à pressão padrão |
| Ponto flash | Não aplicável porque o TFE é um gás |
| Solubilidade em Água | Insolúvel |
| Solubilidade | Solúvel em alguns solventes orgânicos, como acetona e clorofórmio |
| Pressão de vapor | 209,7kPa a 20°C |
| Densidade do vapor | 2,95 (ar = 1) |
| pKa | Não aplicável, pois o TFE não é um ácido nem uma base |
| pH | Não aplicável, pois o TFE não é um ácido nem uma base |
Segurança e perigos do tetrafluoroetileno
O tetrafluoroetileno pode representar vários riscos à segurança e à saúde se não for manuseado adequadamente. A exposição a altas concentrações de TFE pode causar irritação nos olhos, pele e trato respiratório. A exposição prolongada também pode causar danos pulmonares, incluindo edema pulmonar e pneumonia. O TFE também é um gás inflamável que pode formar misturas explosivas com o ar. Portanto, deve ser armazenado e transportado em contêineres especializados para evitar risco de incêndio ou explosão. É importante utilizar equipamento de proteção adequado, incluindo proteção respiratória, ao manusear o TFE para prevenir a exposição e minimizar o risco de efeitos adversos à saúde.
| Símbolos de perigo | F+ (altamente inflamável) |
| Descrição de segurança | Gás altamente inflamável. Causa irritação ocular grave. Pode causar irritação respiratória. |
| Números de identificação da ONU | ONU1080 |
| Código SH | 2903.39 |
| Classe de perigo | 2.1 (Gás inflamável) |
| Grupo de embalagem | Não aplicável porque o TFE é um gás |
| Toxicidade | O TFE tem baixa toxicidade aguda, mas a exposição prolongada pode causar danos aos pulmões e outros efeitos adversos à saúde. O TFE também é considerado um potencial carcinógeno humano. |
Métodos para a síntese de tetrafluoroetileno
O tetrafluoroetileno (TFE) pode ser sintetizado por vários métodos, incluindo decomposição térmica e catalítica de vários compostos de fluorocarbonetos.
Um método comum para sintetizar TFE é a decomposição térmica de clorodifluorometano (CCl2F2) na presença de um iniciador adequado em alta temperatura. O processo envolve a quebra das ligações carbono-cloro no CCl2F2 para formar um radical, que então reage com outras moléculas para produzir TFE.
Outro método é a decomposição catalítica de compostos de fluorocarbonetos, como hexafluoropropeno (HFP) ou octafluorociclobutano (OFCB), sobre um catalisador adequado, como cloreto de alumínio ou pentafluoreto de antimônio, em alta temperatura. Este método produz uma mistura de TFE e outros subprodutos de fluorocarbonetos, que são então separados e purificados.
Além disso, o TFE pode ser sintetizado por fluoração eletroquímica, um processo que envolve a passagem de uma mistura de hidrogênio e gás flúor sobre um ânodo metálico na presença de um eletrólito. Este método produz uma mistura de TFE e outros compostos fluorados, que são então separados e purificados.
No geral, a síntese do TFE requer equipamento e conhecimentos especializados devido à natureza altamente reativa e perigosa dos produtos químicos envolvidos. Portanto, é importante seguir protocolos e regulamentos de segurança adequados ao sintetizar o TFE.
Usos do tetrafluoroetileno
O tetrafluoroetileno (TFE) é um produto químico versátil com diversas aplicações industriais e comerciais.
- Um dos principais usos do TFE é como monômero para a produção de politetrafluoroetileno (PTFE), um polímero antiaderente e resistente ao calor comumente conhecido como Teflon.
- O TFE serve como matéria-prima para a produção de outros compostos fluorados, como ácidos carboxílicos perfluorados e perfluoroalquil sulfonatos, que têm aplicações em eletrônica, têxteis e outras indústrias.
- O TFE desempenha um papel crucial na produção de fluoropolímeros, como o fluoreto de polivinilideno (PVDF), que são amplamente utilizados em revestimentos, tubos e fios devido à sua alta resistência química e durabilidade.
- Os fabricantes utilizam o TFE como refrigerante em sistemas de ar condicionado e refrigeração e na produção de materiais de isolamento de espuma.
- A indústria farmacêutica utiliza TFE como solvente e propelente para formulações de aerossóis.
- O TFE tem muitas aplicações, incluindo revestimentos de panelas, isolamento elétrico e juntas de alto desempenho.
No geral, a versatilidade e as propriedades únicas do TFE fazem dele um produto químico valioso em uma ampla gama de aplicações industriais e comerciais. No entanto, é importante seguir os protocolos e regulamentos de segurança adequados ao manusear o TFE para minimizar o risco de efeitos adversos à saúde e danos ambientais.
Questões:
Quais orbitais atômicos ou híbridos constituem a ligação sigma entre c2 e f no tetrafluoroetileno, c2f4?
A ligação sigma entre C2 e F no tetrafluoroetileno (C2F4) é formada pela sobreposição de orbitais híbridos. Em C2F4, cada átomo de carbono é hibridizado sp2, o que significa que seus três orbitais atômicos (um orbital 2s e dois orbitais 2p) se combinam para formar três orbitais hibridizados sp2, dispostos em uma geometria trigonal planar. Cada átomo de carbono também possui um orbital 2p não hibridizado, perpendicular ao plano dos orbitais sp2.
O átomo de flúor tem um orbital 2p ocupado individualmente que se sobrepõe ao orbital 2p não hibridizado do átomo de carbono adjacente para formar a ligação sigma. Essa sobreposição ocorre ponta a ponta entre os dois átomos, resultando em um arranjo linear de átomos na molécula. Os elétrons na ligação sigma estão localizados principalmente na região entre os dois núcleos, criando uma forte ligação covalente entre os átomos de carbono e flúor.
O Teflon é produzido a partir de tetrafluoroetileno polimerizado?
Sim, o Teflon é produzido pela polimerização do tetrafluoroetileno (TFE). O TFE é um gás incolor e inodoro que pode ser polimerizado na presença de um catalisador para formar politetrafluoroetileno (PTFE), comumente conhecido como Teflon.
O processo de polimerização envolve o início da reação usando um iniciador de radical livre, como persulfato de amônio ou azobisisobutironitrila (AIBN), que gera radicais livres que iniciam a reação em cadeia de monômeros de TFE polimerizados em PTFE.
