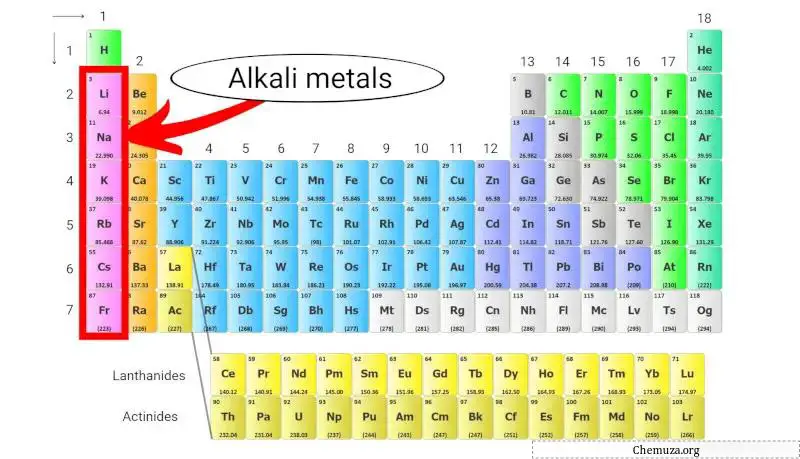
Os metais alcalinos são um grupo de elementos químicos localizados na primeira coluna da tabela periódica . Este grupo inclui lítio , sódio , potássio , rubídio , césio e frâncio .
Os metais alcalinos são macios e têm baixos pontos de fusão e ebulição. Eles são comumente usados em baterias, ligas e diversas reações químicas.
Vamos explorar mais sobre os metais alcalinos da tabela periódica.
O que são metais alcalinos?

Os metais alcalinos são um grupo de elementos químicos da tabela periódica que pertencem ao grupo 1 .
Esses elementos são conhecidos por sua suavidade, baixos pontos de fusão, alta reatividade e capacidade de formar soluções alcalinas ao reagir com água.
Algumas das principais propriedades dos metais alcalinos incluem:
- Eles têm eletronegatividades e energias de ionização baixas, o que significa que tendem a perder elétrons facilmente e formar cátions.
- Eles têm baixos pontos de fusão e ebulição, o que os torna relativamente macios e fáceis de derreter.
- Eles têm alta reatividade com água e oxigênio, tornando-os reativos no ar e na água.
- São bons condutores de calor e eletricidade.
Por que os metais alcalinos são chamados assim?

Os metais alcalinos são assim chamados porque são capazes de formar soluções fortemente alcalinas (básicas) quando reagem com a água. [1]
Quando esses metais entram em contato com a água, liberam gás hidrogênio e formam íons hidróxido, que conferem à solução um pH básico .
Explicação:
A reatividade dos metais alcalinos com a água se deve às suas baixas energias de ionização [2] , o que significa que são capazes de perder facilmente elétrons e formar íons positivos (cátions).
Quando entram em contato com a água, sofrem uma reação química na qual perdem elétrons e reagem com as moléculas de água para formar íons hidróxido e gás hidrogênio.
Essa reação libera muito calor, o que pode fazer com que o gás hidrogênio entre em ignição e exploda.
Ordem de reatividade dos metais alcalinos
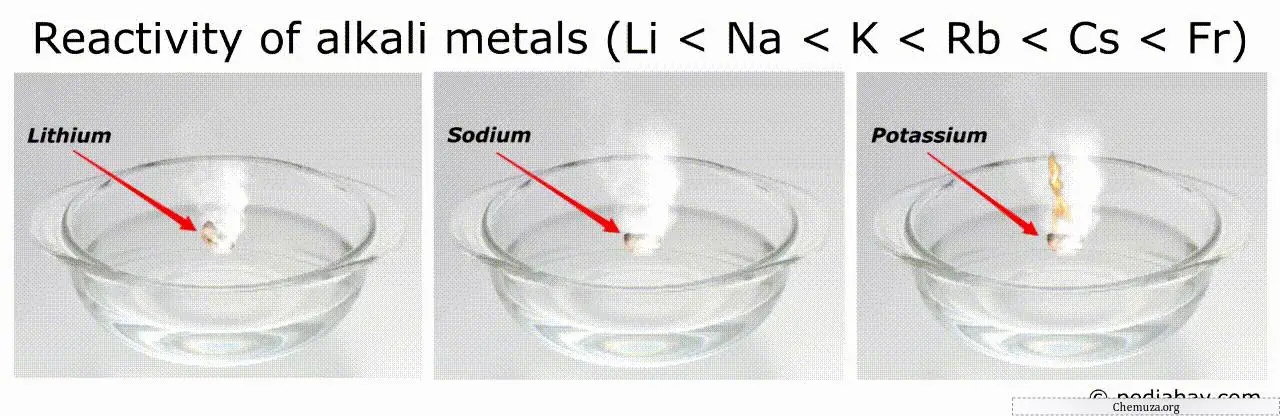
A tendência geral na ordem de reatividade dos metais alcalinos é que ela aumenta à medida que descemos no grupo do lítio (Li) para o frâncio (Fr).
Isto significa que o frâncio é o mais reativo de todos os metais alcalinos, enquanto o lítio é o menos reativo.
A razão para esta tendência é que à medida que descemos no grupo, o raio atômico dos elementos aumenta, enquanto a energia de ionização diminui.
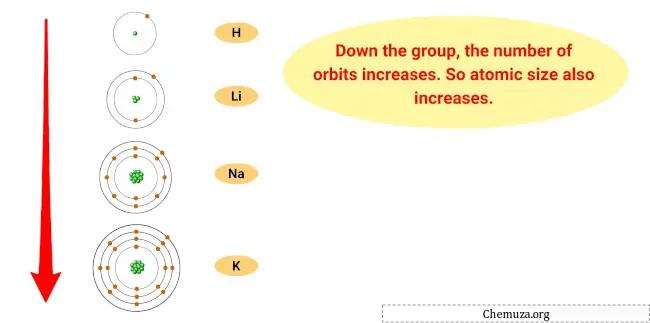
Isso significa que o elétron mais externo dos átomos está mais distante do núcleo e é mantido com menos força, tornando mais fácil para o elemento perder esse elétron e se tornar um cátion.
Francium, sendo o maior e menos relacionado do grupo, é portanto o mais reativo.
Esta ordem de reatividade tem implicações importantes para as propriedades e comportamento dos metais alcalinos.
Por exemplo, os metais mais reativos (como o frâncio e o césio) podem inflamar-se espontaneamente no ar ou na água, tornando-os muito perigosos de manusear.[3]
Por outro lado, metais menos reativos (como o lítio) são mais estáveis e podem ser usados em aplicações que exigem um metal mais estável.
Lista de metais alcalinos e suas configurações eletrônicas
Os metais alcalinos e suas configurações eletrônicas são mostrados abaixo.
| Elemento | Configuração eletronica |
| Lítio (Li) | [É] 2s 1 |
| Sódio (Na) | [Faça] 3s 1 |
| Potássio (K) | [Ar] 4s 1 |
| Rubídio (Rb) | [Kr] 5s 1 |
| Césio (Cs) | [Xe] 6s 1 |
| Francium (fr) | [Rn] 7s 1 |
Tendências periódicas em metais alcalinos
As tendências periódicas dos metais alcalinos são mencionadas abaixo:
- Tendência de Valência: A valência dos metais alcalinos é sempre +1, o que significa que eles tendem a perder um elétron para formar um cátion estável. Portanto, não há mudança na valência dos metais alcalinos à medida que descemos no grupo. Todos eles têm a mesma valência (ou seja, 1).
- Tendência do tamanho atômico: O tamanho atômico dos metais alcalinos aumenta à medida que você desce no grupo, o que significa que os átomos ficam maiores. Isso ocorre porque à medida que você adiciona níveis de energia, o tamanho da nuvem eletrônica aumenta.
- Tendência de caráter metálico: O caráter metálico dos metais alcalinos aumenta à medida que você desce no grupo. Isso ocorre porque os metais se tornam mais eletropositivos e são mais capazes de doar elétrons para formar ligações metálicas.
- Tendência de eletronegatividade: A eletronegatividade dos metais alcalinos diminui à medida que você desce no grupo. Isso ocorre porque os átomos ficam maiores e os elétrons externos ficam mais distantes do núcleo, portanto são menos atraídos por ele.
- Tendência de afinidade eletrônica: A afinidade eletrônica dos metais alcalinos diminui à medida que você desce no grupo. Na verdade, na parte inferior do grupo, o tamanho dos átomos aumenta, o que diminui a tendência de um átomo aceitar o eletrão. (Leia mais sobre a tendência de afinidade eletrônica aqui, para uma compreensão detalhada).
- Tendência da energia de ionização: A energia de ionização dos metais alcalinos diminui à medida que você desce no grupo. Isso significa que é mais fácil remover um elétron da camada mais externa do átomo, porque os elétrons estão mais distantes do núcleo e são mantidos com menos força.
Resumo
Os metais alcalinos são um grupo de elementos químicos conhecidos por sua suavidade, baixo ponto de fusão, alta reatividade e capacidade de formar soluções alcalinas ao reagir com água.
A ordem de reatividade dos metais alcalinos aumenta à medida que você desce no grupo do lítio para o frâncio devido ao aumento do raio atômico e à diminuição da energia de ionização.
As tendências periódicas nos metais alcalinos incluem um aumento no tamanho atômico e no caráter metálico à medida que se desce no grupo, bem como uma diminuição na eletronegatividade, na afinidade eletrônica e na energia de ionização.
A valência dos metais alcalinos é sempre +1 e suas configurações eletrônicas seguem um modelo [gás nobre] ns 1 .
