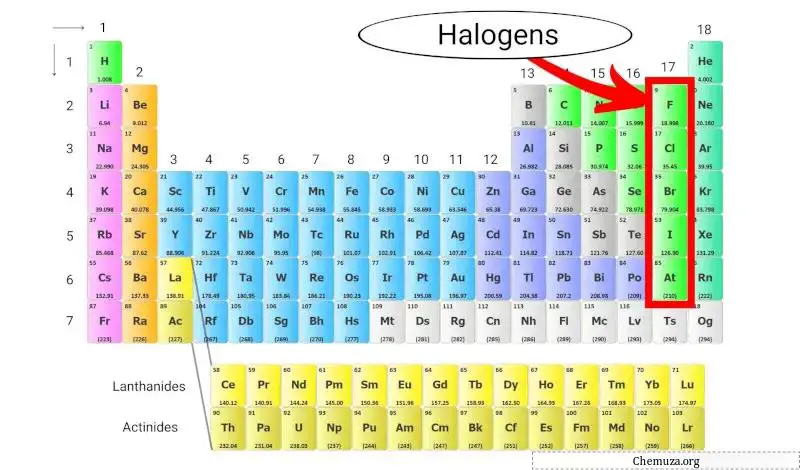
Halogênios são um grupo de elementos encontrados no grupo 17 (também chamado de grupo dos halogênios) da tabela periódica . Os halogênios incluem cinco elementos diferentes: flúor (F), cloro (Cl), bromo (Br), iodo (I) e astato (At).
Os halogênios são únicos porque são o único grupo de elementos capazes de formar compostos com todos os outros elementos da tabela periódica.
Vamos explorar mais os halogênios.
O que são halogênios? E por que eles são chamados assim?
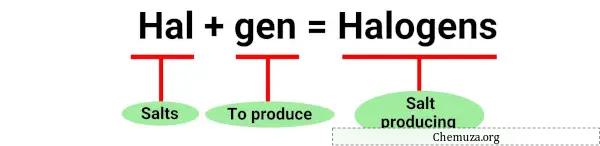
O termo “halogênio” é derivado das palavras gregas “halos” que significa sal e “genes” que significa produtor. [1]
Na verdade, os halogênios foram descobertos pela primeira vez através de sua capacidade de produzir sais ao reagir com metais .
Por exemplo:
Quando o cloro (Cl 2 ) reage com o sódio (Na), forma cloreto de sódio (NaCl), que é um sal de cozinha comum:
2Na + Cl2 → 2NaCl
Da mesma forma, quando o bromo (Br 2 ) reage com o potássio (K), forma brometo de potássio (KBr):
2K + Br2 → 2KBr
Essas reações são exemplos de halogênios que produzem sais quando reagem com metais, daí o nome “halogênio”.
O halogênio mais reativo da tabela periódica
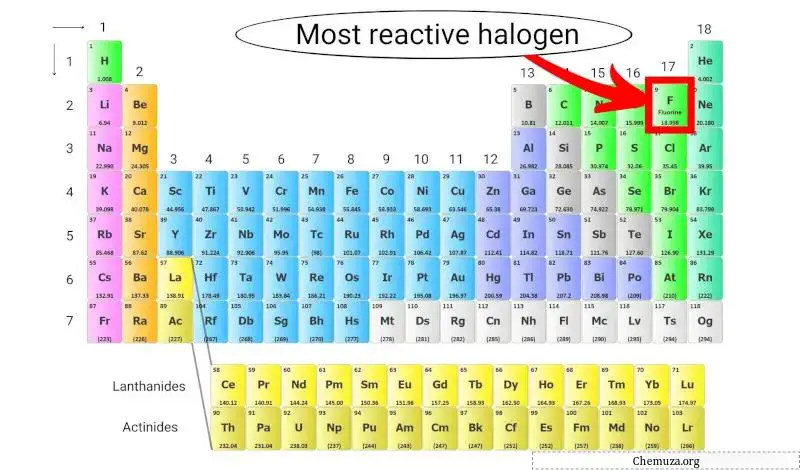
O flúor é o halogênio mais reativo porque possui a maior eletronegatividade de todos os elementos da tabela periódica, o que significa que possui uma forte atração por elétrons.
Isto o torna muito reativo e capaz de reagir com quase todos os outros elementos da tabela periódica para formar compostos. [2]
Simplificando, o flúor é como um ímã para elétrons e fará tudo o que puder para ganhar um elétron e completar sua camada externa.
Ele faz isso reagindo com outros elementos e roubando seus elétrons para formar novos compostos.
É por isso que o flúor é tão reativo e nunca é encontrado na sua forma elementar na natureza, mas sempre existe como um composto.
Devido à sua alta reatividade, o flúor também é extremamente perigoso e pode ser perigoso para uso.
Muitas vezes é manuseado em laboratórios especializados e usado em processos industriais para produzir uma ampla gama de produtos químicos e materiais.
Reatividade de halogênios
Os halogênios são muito reativos devido à sua maior eletronegatividade, o que significa que têm uma capacidade muito alta de atrair elétrons.
Além disso, os halogênios possuem 7 elétrons em sua camada mais externa e precisam apenas de um elétron extra para preenchê-la e atingir uma configuração eletrônica estável como os gases nobres .
Por exemplo, você pode ver que o diagrama de Bohr para o flúor possui 7 elétrons em sua camada mais externa.
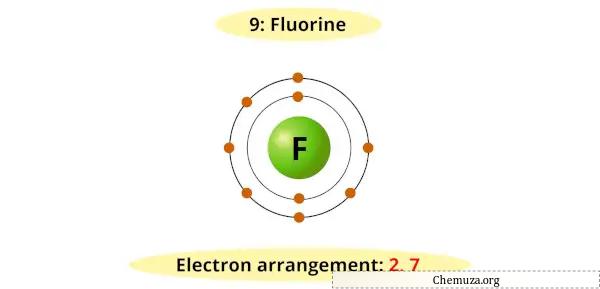
Agora é necessário 1 elétron adicional para obter um octeto estável (7 + 1 = 8).
Os halogênios reagem com os metais para formar compostos iônicos chamados haletos metálicos , que podem produzir chamas brilhantes e coloridas.
Eles também reagem com não metais como hidrogênio , enxofre e nitrogênio para formar uma variedade de compostos covalentes. [3]
Portanto, a tendência dos halogênios de ganhar um elétron e obter uma configuração estável de gás nobre os torna muito reativos e capazes de formar compostos com outros elementos.
Tendências periódicas de halogênio
À medida que avançamos no grupo, os elementos halogéneos apresentam alterações nas suas propriedades físicas, bem como nas suas propriedades químicas.
Vejamos as tendências em algumas propriedades dos halogênios.
- Tamanho atômico: À medida que descemos no grupo, o tamanho atômico dos halogênios aumenta. Isso ocorre porque cada halogênio tem um nível de energia a mais do que aquele acima dele, o que significa que os elétrons mais externos estão mais distantes do núcleo.
- Eletronegatividade: À medida que descemos no grupo, a eletronegatividade dos elementos halogênios diminui. Isto significa que os halogéneos no topo do grupo, como o flúor e o cloro, são mais electronegativos e, portanto, mais propensos a atrair electrões do que os que estão na parte inferior, como o iodo e o astato.
- Pontos de fusão e pontos de ebulição: À medida que descemos no grupo, os pontos de fusão e ebulição dos halogênios aumentam. Na verdade, átomos maiores têm mais elétrons e são capazes de formar forças intermoleculares mais fortes. [4]
- Reatividade em relação aos metais: À medida que descemos no grupo, a reatividade dos halogênios em relação aos metais diminui. Isto significa que os halogéneos no topo do grupo, como o flúor e o cloro, têm maior probabilidade de reagir com metais do que os que estão na parte inferior, como o iodo e o astato.
Resumo
Os halogênios são um grupo de cinco elementos (flúor, cloro, bromo, iodo e astato) encontrados no grupo 17 da tabela periódica. Eles são únicos na sua capacidade de formar compostos com todos os outros elementos.
Os halogênios são muito reativos devido à sua alta eletronegatividade e tendência de ganhar um elétron para atingir uma configuração estável de gás nobre. O flúor é o halogênio mais reativo devido à sua alta eletronegatividade.
À medida que avançamos no grupo, os halogênios exibem mudanças em suas propriedades físicas e químicas, como aumento no tamanho atômico, diminuição na eletronegatividade e aumento nos pontos de fusão e ebulição. A reatividade dos halogênios em relação aos metais também diminui à medida que descemos no grupo.
