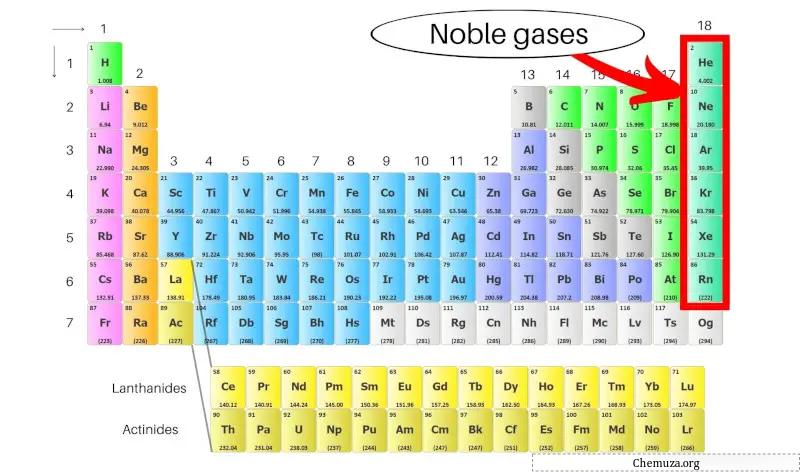
Os gases nobres, também chamados de gases inertes, são um grupo de elementos localizados na coluna mais à direita da tabela periódica . Eles incluem hélio (He), néon (Ne), argônio (Ar), criptônio (Kr), xenônio (Xe) e radônio (Rn).
Esses elementos são conhecidos por sua baixa reatividade devido às suas camadas eletrônicas completas mais externas, tornando-os estáveis e não reativos com outros elementos. [1]
Vamos explorar mais os gases nobres da tabela periódica.
O que são gases nobres?
Os gases nobres são elementos do Grupo 18 que se caracterizam pela sua muito baixa reatividade com outras substâncias, o que significa que geralmente não formam compostos com outros elementos.
Eles também são chamados de gases inertes porque são muito estáveis e não reagem facilmente com outras substâncias. Os gases nobres incluem hélio, néon, argônio, criptônio, xenônio e radônio.
Os gases nobres são encontrados em pequenas quantidades na atmosfera terrestre e são usados em diversas aplicações, como iluminação, soldagem e criogenia. [2]
Por que os gases nobres são inertes?
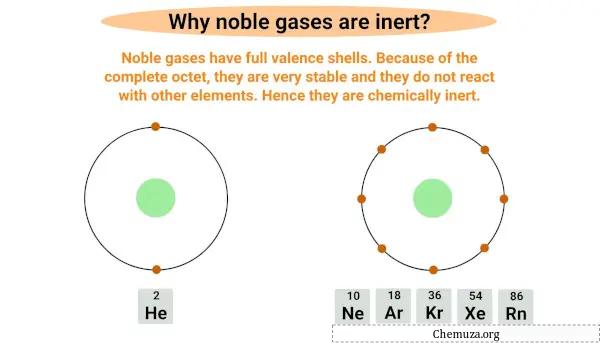
Os gases nobres são inertes ou não reativos porque possuem uma camada de elétrons mais externa completa, também conhecida como camada de valência .
A camada de valência é a camada mais externa de elétrons que envolve um átomo e contém seus elétrons de valência , que são os elétrons envolvidos nas reações químicas.
Os gases nobres são octetos completos, o que significa que possuem uma camada de valência completa com oito elétrons, exceto o hélio que possui apenas dois elétrons em sua camada mais externa.
Ter um byte completo os torna muito estáveis e dificilmente reagirão com outros elementos.
Nas reações químicas, os elementos tendem a ganhar ou perder elétrons para ganhar um octeto completo em sua camada de valência, mas como os gases nobres já possuem uma camada de valência completa, eles não precisam ganhar ou perder elétrons.
Esta configuração estável de gases raros se deve à sua configuração eletrônica.
A camada eletrônica mais externa desses elementos está cheia e, portanto, eles não precisam ganhar ou perder elétrons.
Isto significa que eles são pouco reativos e não tendem a formar ligações químicas com outros elementos.
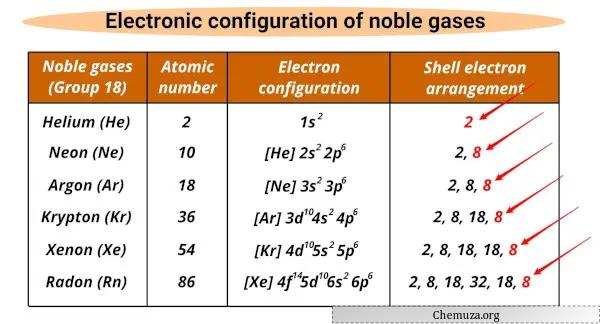
Lista de gases nobres e suas configurações eletrônicas
Os gases nobres e suas configurações eletrônicas são mostrados abaixo.
O que é comum a todos os gases nobres?
Os gases nobres compartilham algumas propriedades comuns .
Todos eles têm o mesmo número de elétrons de valência (8), exceto o hélio que tem 2.
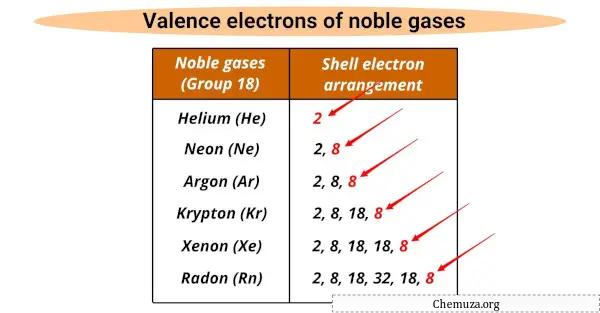
Os elétrons de valência são os elétrons mais externos de um átomo que participam de reações químicas, e os gases nobres possuem uma camada de valência completa que os torna não reativos.
Além disso, os gases nobres são gases incolores que não podemos ver e também são inodoros , o que significa que não têm cheiro. [3]
Finalmente, eles existem naturalmente como gases monoatômicos , o que significa que possuem apenas um átomo em sua forma elementar.
Ao contrário da maioria dos outros elementos que tendem a formar moléculas ligando-se a outros átomos, os gases nobres não precisam de se ligar a outros átomos porque têm uma camada de valência completa, o que os torna muito estáveis e não reativos.
Resumo
Gases nobres são um grupo de elementos encontrados na coluna mais à direita da tabela periódica, incluindo hélio, néon, argônio, criptônio, xenônio e radônio.
Eles são caracterizados pela sua baixa reatividade devido às suas camadas eletrônicas inteiramente externas. Os gases nobres são inertes ou não reativos porque possuem uma camada de valência total, o que os torna muito estáveis e pouco propensos a reagir com outros elementos.
Os gases nobres compartilham propriedades comuns, incluindo o mesmo número de elétrons de valência (8 exceto o hélio que tem 2), um gás incolor e inodoro, e existem naturalmente como gases monoatômicos.
Eles são usados em diversas aplicações, como iluminação, soldagem e criogenia, além de refrigerantes em reatores nucleares e como enchimento de lâmpadas incandescentes.
