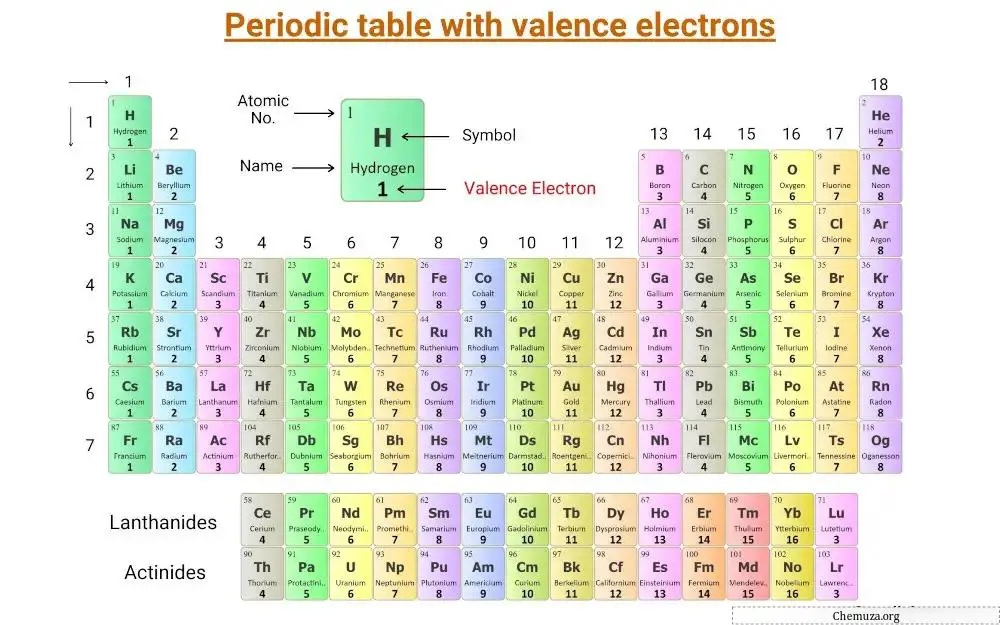
Esta é uma tabela periódica na qual os elétrons de valência são rotulados.
Vamos entender o conceito de elétrons de valência junto com o número de elétrons de valência dos elementos do grupo principal e dos elementos de transição .
O que são elétrons de valência?
Elétrons de valência são os elétrons localizados na camada mais externa ou no nível de energia de um átomo que estão envolvidos na ligação química.
Por exemplo, o magnésio possui 2 elétrons em sua órbita mais externa, portanto possui 2 elétrons de valência. [1]
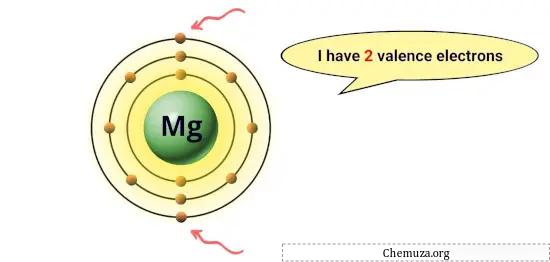
Esses elétrons são responsáveis pelas propriedades químicas de um elemento, como sua reatividade e os tipos de ligações químicas que ele pode formar com outros átomos.
O número de elétrons de valência que um átomo possui determina sua posição na tabela periódica e sua capacidade de formar ligações químicas .
Elétrons de valência dos principais elementos do grupo
Os principais elementos do grupo, também chamados de elementos representativos, estão localizados nos grupos 1, 2 e 13 a 18 da tabela periódica.
O número de elétrons de valência nesses elementos é igual ao número do grupo.
Por exemplo, os elementos do Grupo 1, como o lítio e o sódio , possuem um elétron de valência, enquanto os elementos do Grupo 2, como o magnésio e o cálcio , possuem dois elétrons de valência.
Os elementos do grupo 13, como boro e alumínio , possuem três elétrons de valência e assim por diante.
Esses elétrons de valência são responsáveis pelas propriedades químicas e reatividade únicas dos elementos.
Elétrons de valência de transição e elementos de transição interna
Os elétrons de valência dos elementos de transição e dos elementos de transição internos são mais complicados de determinar do que os dos elementos do grupo principal.
Na verdade, a subcamada d dos elementos de transição e a subcamada f dos elementos de transição internos estão incompletamente preenchidas e estão muito próximas da subcamada externa s.
Como resultado, os elétrons dos subníveis d e s nos elementos de transição e dos subníveis f e s nos elementos de transição internos podem se comportar como elétrons de valência.
Para elementos de transição, os elétrons de valência podem variar de 3 a 12 devido à contribuição dos elétrons do subnível d e do subnível s. Em alguns casos, os elétrons em orbitais d incompletos também são considerados elétrons de valência. [2]
Da mesma forma, para elementos de transição internos (ou elementos do bloco f), os elétrons de valência podem variar de 3 a 16 devido à contribuição dos elétrons do subnível f e do subnível s. [3] Elétrons em orbitais d incompletos também podem ser considerados elétrons de valência em alguns metais de transição internos.
É importante notar que para elementos de transição e de transição interna, os elétrons de valência são os elétrons presentes nas camadas fora do núcleo do gás nobre.
