Sulfeto de sódio (sulfeto) é um composto químico com a fórmula Na2S. É comumente utilizado na indústria de papel e celulose, bem como no tratamento de água para remoção de metais pesados.
| Nome IUPAC | Sulfeto dissódico |
| Fórmula molecular | Na2S |
| Número CAS | 1313-82-2 |
| Sinônimos | Sulfeto de sódio, monossulfeto de sódio, sulfeto dissódico, sulfeto de sódio anidro, sulfeto de sódio não hidratado, sulfeto de sódio |
| InChI | InChI=1S/2Na.S/q2*+1;-2 |
Massa molar de sulfeto de sódio
O sulfeto de sódio tem massa molar de 78,045 g/mol. Isto significa que um mol de sulfeto de sódio contém 78,045 gramas do composto. A massa molar é uma quantidade útil para calcular a quantidade de uma substância necessária para uma reação, bem como para determinar o peso molecular de um composto.
Ponto de ebulição do sulfeto de sódio
O sulfeto de sódio tem um ponto de ebulição relativamente alto de >1180°C (2156°F). Isso significa que é necessária uma quantidade significativa de energia para converter a forma sólida do sulfeto de sódio em sua forma gasosa. O alto ponto de ebulição também indica que o sulfeto de sódio é um composto estável em altas temperaturas.
Ponto de fusão do sulfeto de sódio
O sulfeto de sódio tem um ponto de fusão de 1.180°C (2.156°F). Isso significa que é necessária uma quantidade significativa de energia para converter a forma sólida do sulfeto de sódio em sua forma líquida. O alto ponto de fusão do sulfeto de sódio também indica que é um composto estável em altas temperaturas.
Densidade de sulfeto de sódio g/ml
A densidade do sulfeto de sódio varia dependendo da sua forma. A forma anidra do sulfeto de sódio tem densidade de 1,856 g/mL, enquanto a forma nonahidratada tem densidade de 1,58 g/mL. A densidade de uma substância é a massa por unidade de volume e é uma quantidade útil para determinar a concentração de uma solução.
Peso molecular de sulfeto de sódio
O peso molecular do sulfeto de sódio é 78,045 g/mol. Isso significa que um mol de sulfeto de sódio contém 6,022 x 10 ^ 23 moléculas do composto. O peso molecular é uma quantidade útil para calcular a quantidade de uma substância necessária para uma reação, bem como para determinar a massa molar de um composto.
Estrutura do sulfeto de sódio
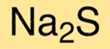
O sulfeto de sódio possui estrutura cristalina em sua forma anidra. O composto forma cristais incolores altamente solúveis em água. A estrutura do composto é composta por cátions de sódio (Na+) e ânions sulfeto (S2-). O composto tem uma forte ligação iônica entre os íons sódio e sulfeto.
Fórmula de Sulfeto de Sódio
A fórmula química do sulfeto de sódio é Na2S. Isto significa que cada molécula de sulfeto de sódio contém dois cátions de sódio e um ânion sulfeto. A fórmula é útil para compreender a composição química do composto e determinar suas propriedades.
| Aparência | Sólido amarelo a marrom-amarelado, deliquescente |
| Gravidade Específica | 1,856 (anidro), 1,58 (não hidratado) |
| Cor | Incolor a amarelo |
| Cheiro | Cheiro de ovo podre |
| Massa molar | 78,045 g/mol |
| Densidade | 1,856 g/mL (anidro), 1,58 g/mL (não hidratado) |
| Ponto de fusão | 1180°C (2156°F) |
| Ponto de ebulição | >1180°C (2156°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Muito solúvel |
| Solubilidade | Solúvel em etanol, glicerol |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Alcalino, pH ~12 |
Segurança e perigos do sulfeto de sódio
O sulfeto de sódio pode representar vários riscos à segurança. É muito reativo com água e pode causar irritação severa na pele e nos olhos em contato. A inalação do composto pode causar irritação do trato respiratório e causar náuseas, vômitos e diarreia se ingerido. O composto também é altamente inflamável e pode reagir violentamente com agentes oxidantes. É importante manusear o sulfeto de sódio com cuidado e usar equipamentos de proteção adequados, como luvas e óculos de proteção. Ventilação adequada também deve ser garantida ao manusear o composto. Se exposto, deve-se procurar atendimento médico imediato.
| Símbolos de perigo | Corrosivo, Tóxico |
| Descrição de segurança | Não respirar poeiras/fumos/gases/névoas/vapores/aerossóis. Use luvas de proteção/roupas de proteção/proteção ocular/proteção facial. EM CASO DE INALAÇÃO: Remover a vítima para um local ao ar livre e mantê-la em repouso numa posição confortável para respirar. SE ENTRAR EM CONTACTO COM OS OLHOS: enxaguar cuidadosamente com água durante vários minutos. Remova as lentes de contato, se presentes e fáceis de retirar. Continue enxaguando. SE ENTRAR EM CONTACTO COM A PELE (ou cabelo): Remova imediatamente todas as roupas contaminadas. Enxaguar a pele com água/tomar banho. EM CASO DE INGESTÃO: Enxágue a boca. NÃO induza o vômito. Ligue imediatamente para um CENTRO DE INFORMAÇÃO ANTIVENENOS ou um médico. |
| Identificadores AN | ONU1849 |
| Código SH | 2830.10.00 |
| Classe de perigo | 8 |
| Grupo de embalagem | II |
| Toxicidade | Muito tóxico; pode causar irritação grave na pele e nos olhos, irritação do trato respiratório, náusea, vômito e diarréia se ingerido. Pode ser fatal se engolido. |
Métodos para a síntese de sulfeto de sódio
Existem vários métodos para sintetizar sulfeto de sódio:
Um método comum é reagir hidróxido de sódio (NaOH) com enxofre (S) em um forno de alta temperatura para produzir sulfeto de sódio (Na2S) e água (H2O).
Outro método envolve a reação de dióxido de enxofre (SO2) com sulfeto de sódio (Na2S) para formar tiossulfato de sódio (Na2S2O3) e, em seguida, reagir com hidróxido de sódio (NaOH) para formar sulfeto de sódio e sódio (Na2S) e água (H2O).
Um terceiro método envolve a redução do sulfato de sódio (Na2SO4) com carbono na presença de carvão vegetal em altas temperaturas para produzir sulfeto de sódio (Na2S), dióxido de carbono (CO2) e monóxido de carbono (CO).
Outro método envolve a reação de carbonato de sódio (Na2CO3) com enxofre (S) na presença de carvão vegetal em altas temperaturas para produzir sulfeto de sódio (Na2S), dióxido de carbono (CO2) e monóxido de carbono. carbono (CO).
Para sintetizar o sulfeto de sódio, o sulfeto de sódio nonahidratado (Na2S.9H2O) pode reagir com ácido sulfúrico (H2SO4) para produzir sulfato de sódio (Na2SO4) e dióxido de enxofre (SO2). Em seguida, aqueça o sulfato de sódio com carvão para produzir sulfeto de sódio (Na2S) e dióxido de carbono (CO2).
No geral, existem diferentes métodos para sintetizar o sulfeto de sódio, e a escolha de um método específico depende de fatores como pureza desejada, quantidade e economia do produto.
Usos do sulfeto de sódio
O sulfeto de sódio atende diversas indústrias com uma ampla gama de utilizações.
A indústria do couro comumente o utiliza como agente depilatório para remover pelos e lã de couros e peles.
É utilizado como agente sulfurizante para produzir corantes de enxofre para têxteis e como agente redutor na fabricação de outros produtos químicos, como o hidrossulfito de sódio.
Na indústria de celulose e papel, o sulfeto de sódio atua como agente branqueador e ajuda a remover a lignina da polpa de madeira.
Também é usado como agente de flotação na mineração para separar minérios de cobre, chumbo e zinco de sua ganga.
Na indústria de tratamento de águas residuais, o sulfeto de sódio é usado como agente redutor para remover metais pesados dos fluxos de efluentes. Além disso, auxilia como agente desclorante na remoção do cloro residual nos processos de tratamento de água.
A indústria farmacêutica utiliza sulfeto de sódio na produção de determinados medicamentos e como agente redutor em reações de química orgânica.
Os laboratórios o utilizam como reagente em química analítica e como fonte de íons de enxofre em síntese química.
No geral, o sulfeto de sódio é um composto versátil com diversas aplicações em diversos setores. Suas propriedades químicas únicas o tornam útil como agente redutor, agente depilatório, agente de flotação e agente desclorante, entre outros.
Questões:
P: Qual é a carga do cátion no composto iônico sulfeto de sódio?
R: O cátion do sulfeto de sódio é o sódio (Na+), que tem carga +1.
P: Qual é a fórmula do sulfeto de sódio?
R: A fórmula do sulfeto de sódio é Na2S, que representa o composto iônico formado pela combinação de um cátion sódio (Na+) e um ânion sulfeto (S2-).
P: Qual é a fórmula do sulfeto de sódio?
R: A fórmula do sulfeto de sódio é Na2S, que representa o composto iônico formado pela combinação de um cátion sódio (Na+) e um ânion sulfeto (S2-).
P: O sulfeto de sódio é solúvel?
R: O sulfeto de sódio é solúvel em solventes polares como água e etanol, mas é insolúvel em solventes apolares como benzeno e clorofórmio.
P: O sulfeto de sódio é solúvel em água?
R: Sim, o sulfeto de sódio é altamente solúvel em água, com solubilidade de aproximadamente 50g/100ml em temperatura ambiente. Quando o sulfeto de sódio é dissolvido em água, ele sofre hidrólise para formar hidróxido de sódio e gás sulfeto de hidrogênio.
