O sulfato de sódio é um composto cristalino branco com a fórmula Na2SO4. É utilizado nas indústrias de detergentes, fabricação de papel e vidro como enchimento, agente secante e antiespumante.
| Nome IUPAC | Sulfato dissódico |
| Fórmula molecular | Na2SO4 |
| Número CAS | 7757-82-6 |
| Sinônimos | Sulfato dissódico, sulfato de sódio anidro, sulfato de sódio |
| InChI | InChI=1S/2Na.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Na2So4 Massa molar
O sulfato de sódio tem massa molar de 142,04 g/mol. É um composto iônico composto por dois cátions de sódio (Na+) e um ânion sulfato (SO42-). A massa molar é calculada adicionando as massas atômicas de todos os átomos de uma molécula de sulfato de sódio. Neste caso, temos dois átomos de sódio com massa de 22,99 g/mol cada, um átomo de enxofre com massa de 32,06 g/mol e quatro átomos de oxigênio com massa de 15,99 g/mol cada. Somá-los nos dá a massa molar do sulfato de sódio.
Ponto de ebulição do sulfato de sódio
O sulfato de sódio tem um ponto de ebulição alto de 1.429 °C (2.604 °F). Isto se deve à natureza iônica do composto, que cria fortes forças eletrostáticas de atração entre os íons sódio carregados positivamente e os íons sulfato carregados negativamente. Superar essas forças requer uma grande quantidade de energia, razão pela qual o ponto de ebulição do sulfato de sódio é tão alto.
Ponto de fusão do sulfato de sódio
O ponto de fusão do sulfato de sódio varia dependendo do seu teor de água. O sulfato de sódio anidro (sem água) tem um ponto de fusão de 884°C (1.623°F). No entanto, o sulfato de sódio deca-hidratado (com dez moléculas de água) derrete a uma temperatura mais baixa de 32,4°C (90,3°F). A presença de moléculas de água na estrutura cristalina do sulfato de sódio deca-hidratado enfraquece as ligações iônicas entre os íons sódio e sulfato, reduzindo o ponto de fusão.
Densidade de sulfato de sódio g/ml
A densidade do sulfato de sódio varia dependendo da sua forma. O sulfato de sódio anidro tem densidade de 2,664 g/cm3, enquanto o sulfato de sódio decaidratado tem densidade de 1,464 g/cm3. A diferença de densidade se deve à presença de moléculas de água na estrutura cristalina do decaidrato, o que aumenta seu volume e diminui sua densidade.
Peso Molecular do Sulfato de Sódio
O peso molecular do sulfato de sódio é 142,04 g/mol. Esta é a massa de uma molécula de sulfato de sódio, composta por dois íons sódio e um íon sulfato.
Estrutura do sulfato de sódio
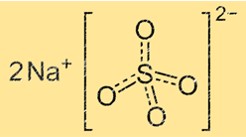
O sulfato de sódio tem uma estrutura cristalina que consiste em unidades repetidas de íons sódio e sulfato. O íon sulfato é um tetraedro com quatro átomos de oxigênio nos cantos e um átomo de enxofre no centro. O íon sódio é uma pequena esfera localizada entre os íons sulfato. A estrutura cristalina do sulfato de sódio pode variar dependendo do seu teor de água. O sulfato de sódio anidro tem uma estrutura cristalina diferente do sulfato de sódio deca-hidratado.
Fórmula de sulfato de sódio
A fórmula química do sulfato de sódio é Na2SO4. Isso significa que cada molécula de sulfato de sódio contém dois íons de sódio (Na+) e um íon sulfato (SO42-). A fórmula representa a proporção inteira mais simples de átomos em uma molécula do composto.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 2.664 g/cm3 (anidro), 1.464 g/cm3 (decaidrato) |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 142,04 g/mol |
| Densidade | 2.664 g/cm3 (anidro), 1.464 g/cm3 (decaidrato) |
| Ponto de fusão | 884°C (anidro), 32,4°C (decaidrato) |
| Ponto de ebulição | 1.429°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 44,1 g/100 mL (anidro), 47,6 g/100 mL (decaidrato) |
| Solubilidade | Solúvel em água, insolúvel em etanol |
| Pressão de vapor | 0,01 mmHg a 20°C |
| Densidade do vapor | Não aplicável |
| pKa | 1º: 2,01, 2º: 7,20, 3º: 9,41 |
| pH | 9-11 (solução a 10%) |
Segurança e perigos do sulfato de sódio
O sulfato de sódio é geralmente considerado seguro para uso, mas pode causar irritação ou danos em certas circunstâncias. Pode irritar a pele, os olhos e o sistema respiratório por contato ou inalação. A ingestão de grandes quantidades pode causar náuseas, vômitos e diarreia. Também pode ser prejudicial à vida aquática se for lançado nos cursos de água. O sulfato de sódio não é considerado um material inflamável ou explosivo. Porém, quando aquecido ou exposto a altas temperaturas, pode liberar vapores tóxicos. É importante seguir os procedimentos de manuseio adequados, usar equipamento de proteção e armazenar o sulfato de sódio em local seguro.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | S24/25: Evitar contato com a pele e os olhos. S36/37: Use roupas e luvas de proteção adequadas. |
| Números de identificação da ONU | ONU 2118 |
| Código SH | 2833.11.00 |
| Classe de perigo | Não perigoso |
| Grupo de embalagem | Não aplicável |
| Toxicidade | LD50 (oral, rato): 5.900 mg/kg |
Métodos para a síntese de sulfato de sódio
Existem diferentes métodos para sintetizar sulfato de sódio, incluindo a reação de cloreto de sódio com ácido sulfúrico ou a reação de hidróxido de sódio com ácido sulfúrico.
Para produzir sulfato de sódio, a reação do cloreto de sódio e do ácido sulfúrico gera sulfato de sódio e cloreto de hidrogênio gasoso. O processo minimiza os vapores nocivos realizando a reação exotérmica sob condições controladas. Posteriormente, a solução passa por filtração antes da evaporação para produzir cristais de sulfato de sódio.
A síntese do sulfato de sódio também envolve a combinação de ácido sulfúrico e hidróxido de sódio para formar sulfato de sódio e água. A reação é exotérmica e requer manuseio cuidadoso para evitar transbordamento. Após filtrar a mistura, a solução resultante é submetida a evaporação para produzir cristais de sulfato de sódio.
Outro método envolve a reação do carbonato de sódio com ácido sulfúrico, produzindo sulfato de sódio, água e dióxido de carbono. Este método requer o uso de uma capela devido à liberação de vapores tóxicos. A solução é então filtrada e evaporada para obter cristais de sulfato de sódio.
Outros processos industriais, como a produção de rayon, detergentes e vidro, também produzem sulfato de sódio como subproduto. Esses processos produzem sulfato de sódio como resíduo, que pode ser purificado e reaproveitado para outros fins.
Usos do sulfato de sódio
O sulfato de sódio tem uma ampla gama de utilizações em diversas indústrias, incluindo:
- Detergentes: Utilizados como enchimento em detergentes em pó, ajudando a aumentar o volume e melhorar o fluxo do produto.
- Vidro: Utilizado como fundente na fabricação de vidro, auxiliando na redução do ponto de fusão e melhorando a clareza do produto final.
- Têxteis: Utilizado na produção de fibras sintéticas, como o rayon, para melhorar a resistência e durabilidade do material.
- Papel: Utilizado como agente de celulose na produção de papel, auxiliando na quebra das fibras da madeira e na remoção de impurezas.
- Alimentos: Utilizado como aditivo alimentar, principalmente como espessante e emulsificante em alimentos processados.
- Produtos farmacêuticos: Utilizados na produção de certos medicamentos, como laxantes, para ajudar no tratamento da constipação.
- Produtos químicos: Usados na produção de vários produtos químicos, incluindo sulfeto de sódio, silicato de sódio e bicarbonato de sódio.
- Tratamento de Água: Usado em estações de tratamento de água para remover íons de cálcio e magnésio da água dura.
- Perfuração de petróleo: Utilizado na perfuração de petróleo como agente de ponderação, auxiliando no controle da densidade do fluido de perfuração.
Questões:
P: Qual é a fórmula do sulfato de sódio?
R: A fórmula química do sulfato de sódio é Na2SO4.
P: O que é sulfato de sódio?
R: O sulfato de sódio é um sólido cristalino branco comumente usado em uma variedade de aplicações industriais, incluindo detergentes, vidro, têxteis, papel e alimentos.
P: O sulfato de sódio é ácido ou básico?
R: O sulfato de sódio não é ácido nem básico; é um composto neutro.
P: Qual é a cor do sulfato de sódio? R: O sulfato de sódio é um sólido cristalino branco e, portanto, é incolor.
