O sulfato de potássio (K2SO4) é um composto que contém potássio, enxofre e oxigênio. É comumente usado como fertilizante para fornecer nutrientes essenciais às plantas e melhorar a qualidade do solo.
| Nome IUPAC | Sulfato de potássio |
| Fórmula molecular | K2SO4 |
| Número CAS | 7778-80-5 |
| Sinônimos | Ácido sulfúrico, sal dipotássico; Sulfato dipotássico; Arcanita; Ácido sulfúrico, sal de potássio (1:2); sulfato de potássio; sal policrestum; duplicado arcano |
| InChI | InChI=1S/2K.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Propriedades do sulfato de potássio
Fórmula de sulfato de potássio
A fórmula química do sulfato de potássio é K2SO4. Isto significa que cada molécula de sulfato de potássio contém dois átomos de potássio, um átomo de enxofre e quatro átomos de oxigênio. A fórmula do sulfato de potássio é útil para determinar a estequiometria das reações envolvendo o composto, bem como para calcular a quantidade de sulfato de potássio necessária para uma aplicação específica.
Massa molar de sulfato de potássio
K2SO4 tem massa molar de aproximadamente 174.259 g/mol. Este valor é calculado somando as massas atômicas de cada elemento do composto, que são dois átomos de potássio, um átomo de enxofre e quatro átomos de oxigênio. A massa molar é um valor útil para determinar a quantidade de K2SO4 necessária para uma aplicação específica, como produção de fertilizantes ou experimentos de laboratório.
Ponto de ebulição do sulfato de potássio
O ponto de ebulição do K2SO4 é de aproximadamente 1.690 °C (3.074 °F). Esta é a temperatura na qual o composto muda de líquido para gasoso. O alto ponto de ebulição do K2SO4 o torna útil para aplicações que exigem estabilidade em altas temperaturas, como na produção de fertilizantes e produtos químicos industriais.
Ponto de fusão do sulfato de potássio
O ponto de fusão do K2SO4 é de aproximadamente 1,069 °C (1,956 °F). Esta é a temperatura na qual o composto sólido passa para o estado líquido. O ponto de fusão relativamente alto do K2SO4 o torna útil para aplicações em altas temperaturas, como na produção de vidro, cerâmica e fertilizantes.
Densidade de sulfato de potássio g/mL
A densidade do K2SO4 é de aproximadamente 2,66 g/mL à temperatura ambiente. Isto significa que um mililitro de K2SO4 pesa 2,66 gramas. A densidade do K2SO4 depende da temperatura e da pressão e pode ser usada para calcular a massa ou volume do composto necessário para uma aplicação específica.
Peso Molecular do Sulfato de Potássio
O peso molecular do K2SO4 é 174.259 g/mol. Este valor é calculado somando os pesos atômicos de todos os elementos do composto. O peso molecular é útil para calcular a quantidade de K2SO4 necessária para aplicações específicas, como fertilizantes ou produtos químicos industriais.
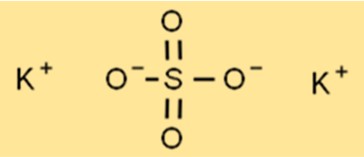
Estrutura do sulfato de potássio
A estrutura do K2SO4 é uma estrutura de rede cristalina, com cada íon de potássio cercado por seis íons de oxigênio de formato octaédrico. O átomo de enxofre está localizado no centro da rede, com cada átomo de enxofre rodeado por quatro íons de oxigênio em forma tetraédrica. Essa estrutura reticular confere ao K2SO4 suas propriedades características, como altos pontos de fusão e ebulição.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 2,66 a 20°C |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 174.259 g/mol |
| Densidade | 2,66 g/cm³ a 20°C |
| Ponto de fusão | 1069°C (1956°F) |
| Ponto de ebulição | 1.690°C (3.074°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 111 g/L a 20°C |
| Solubilidade | Solúvel em água, insolúvel em etanol |
| Pressão de vapor | 0,0 mmHg a 25°C |
| Densidade do vapor | Não aplicável |
| pKa | 1º: 2,17; 2º: 7h20; 3º: 11,8 |
| pH | 5,5-8,5 (solução a 1%) |
Segurança e perigos do sulfato de potássio
O K2SO4 é geralmente considerado seguro para uso em ambientes industriais, agrícolas e laboratoriais. No entanto, o composto pode causar irritação ou danos à pele, olhos e sistema respiratório se ingerido ou inalado em grandes quantidades. Além disso, o K2SO4 pode reagir com certos produtos químicos, como ácidos fortes, para produzir fumos ou incêndios perigosos. É importante manusear o K2SO4 com cuidado, utilizando equipamento de proteção adequado e seguindo as instruções de segurança. O armazenamento de K2SO4 deve ser feito em uma área fresca, seca e bem ventilada, longe de materiais incompatíveis.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | S24/25: Evitar contato com a pele e os olhos. |
| Números de identificação da ONU | ONU 6066 |
| Código SH | 3104.30.00 |
| Classe de perigo | Não é perigoso para transporte |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Baixa toxicidade |
Métodos de síntese de sulfato de potássio
Existem vários métodos para sintetizar K2SO4.
Um método comum envolve a reação do cloreto de potássio com ácido sulfúrico . A reação produz K2SO4 e cloreto de hidrogênio como subproduto.
Outro método envolve a reação do hidróxido de potássio com ácido sulfúrico . Esta reação também produz K2SO4 e água como subproduto.
O K2SO4 também pode ser obtido a partir do mineral langbeinita, que é um mineral natural que contém K2SO4, sulfato de magnésio e cloreto de sódio. Normalmente, os mineradores extraem o mineral e o processam para remover impurezas e separar o K2SO4.
Outro método de produção de K2SO4 envolve a reação do carbonato de potássio com ácido sulfúrico . Esta reação produz K2SO4 e dióxido de carbono como subproduto.
Usos do sulfato de potássio
K2SO4 possui uma ampla gama de aplicações em diversos setores. Aqui estão alguns dos usos mais comuns do K2SO4:
- Fertilizante: Um fertilizante popular devido ao seu alto teor de potássio. Usado no cultivo de frutas, vegetais e outras culturas.
- Indústria do vidro: Usado como fundente na produção de vidro. Isso ajuda a diminuir o ponto de fusão do vidro e a melhorar sua durabilidade.
- Indústria farmacêutica: utilizado como componente em diversos medicamentos, incluindo laxantes e soluções de reposição eletrolítica.
- Indústria alimentícia: Utilizado como aditivo alimentar para regular a acidez e como agente de saída em produtos de panificação.
- Aplicações Industriais: Utilizado em diversas aplicações industriais, incluindo a produção de alumínio, carbonato de potássio e outros produtos químicos.
- Alimentação Animal: Usado como suplemento dietético para gado e aves para promover crescimento e desenvolvimento saudáveis.
- Tratamento de Água: Utilizado no tratamento de água para controle de incrustações e corrosão em caldeiras e outros equipamentos.
Questões:
P: O sulfato de potássio é solúvel?
R: Sim, K2SO4 é solúvel em água. Possui solubilidade de aproximadamente 111 g/L à temperatura ambiente.
P: Qual será o produto sólido quando o brometo de estrôncio e o sulfato de potássio reagem?
R: Quando o brometo de estrôncio e o K2SO4 reagem, o produto sólido formado é o sulfato de estrôncio (SrSO4), que é um sólido branco insolúvel.
P: O que mais é produzido na reação de substituição do nitrato de prata e do sulfato de potássio?
R: Na reação de substituição de nitrato de prata e K2SO4, também são produzidos sulfato de prata (Ag2SO4) e nitrato de potássio (KNO3).
P: O sulfato de potássio é um ácido ou uma base?
R: K2SO4 não é um ácido nem uma base, é um sal. É formado a partir da reação de neutralização entre um ácido (ácido sulfúrico) e uma base (hidróxido de potássio).
P: O k2so4 é solúvel em água?
R: Sim, K2SO4 é solúvel em água. É muito solúvel e sua solubilidade aumenta com a temperatura.
P: Que sal é produzido quando o h2so4 reage com o naoh? k2so3 na2so4 na2so3 k2so4 A: Quando H2SO4 reage com NaOH, o sal produzido é Na2SO4 (sulfato de sódio) com água.
P: Quantos mols de k2so4 existem em 15,0 g de k2so4?
R: Para determinar o número de moles de K2SO4 em 15,0 g de K2SO4, precisamos dividir a massa dada pela massa molar de K2SO4 que é 174,259 g/mol. Portanto, o número de moles de K2SO4 em 15,0 g é 0,086 moles.
P: Qual seria a fórmula do precipitado que se forma quando pb(no3)2 (aq) e k2so4 (aq) são misturados?
R: Quando Pb(NO3)2 (aq) e K2SO4 (aq) são misturados, o precipitado formado é PbSO4 (sulfato de chumbo), que é um sólido branco insolúvel. A equação balanceada para esta reação é Pb(NO3)2 + K2SO4 → PbSO4 + 2KNO3.
