O sulfato de níquel (NiSO4) é um composto formado por átomos de níquel, enxofre e oxigênio. É comumente usado em galvanoplastia, catalisadores e como nutriente em alguns fertilizantes.
| Nome IUPAC | Sulfato de níquel (II) |
| Fórmula molecular | NiSO4 |
| Número CAS | 7786-81-4 |
| Sinônimos | Sulfato de níquel, sal de níquel de ácido sulfúrico, sulfato de níquel (II), níquel (2+); sulfato |
| InChI | InChI=1S/Ni.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Propriedades do sulfato de níquel
Fórmula de sulfato de níquel
A fórmula química do sulfato de níquel é NiSO4. Representa a combinação de um átomo de níquel (Ni) e um grupo sulfato (SO4). A fórmula indica claramente a presença de níquel e enxofre, além de oxigênio no grupo sulfato.
Massa molar de sulfato de níquel
A massa molar do sulfato de níquel (NiSO4) é calculada somando as massas atômicas de seus elementos constituintes. O níquel (Ni) tem uma massa atômica de aproximadamente 58,69 gramas por mol, enquanto o enxofre (S) tem uma massa atômica de aproximadamente 32,07 gramas por mol e o oxigênio (O) tem uma massa atômica de cerca de 16 gramas por mol. Ao adicionar estes valores, a massa molar do sulfato de níquel é determinada como sendo aproximadamente 154,76 gramas por mol.
Ponto de ebulição do sulfato de níquel
O sulfato de níquel não possui ponto de ebulição específico porque se decompõe quando aquecido. Porém, é importante ressaltar que sua temperatura de decomposição é influenciada por fatores como pressão e presença de outras substâncias. Portanto, é aconselhável manusear o sulfato de níquel com cautela quando exposto a altas temperaturas.
Ponto de fusão do sulfato de níquel
O ponto de fusão do sulfato de níquel é de cerca de 100 graus Celsius (212 graus Fahrenheit). A esta temperatura, a forma sólida do sulfato de níquel muda para o estado líquido. Vale ressaltar que variações na pureza e na estrutura cristalina do sulfato de níquel podem afetar levemente seu ponto de fusão.
Densidade de sulfato de níquel g/mL
A densidade do sulfato de níquel refere-se à sua massa por unidade de volume. A densidade do sulfato de níquel é normalmente em torno de 3,68 gramas por mililitro (g/mL). Deve-se notar que a densidade pode variar dependendo da temperatura e pureza da amostra.
Peso molecular do sulfato de níquel
O peso molecular do sulfato de níquel (NiSO4) é a soma dos pesos atômicos de seus elementos constituintes. Conforme mencionado anteriormente, o peso molecular do sulfato de níquel é de aproximadamente 154,76 gramas por mol.
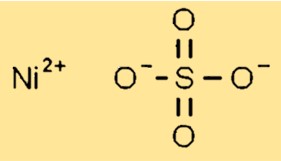
Estrutura do sulfato de níquel
O sulfato de níquel possui estrutura cristalina no estado sólido. Forma cristais monoclínicos com cada íon de níquel (Ni2+) cercado por seis átomos de oxigênio de grupos sulfato. Os grupos sulfato estão dispostos de forma a permitir uma compactação eficiente da rede cristalina.
Solubilidade do sulfato de níquel
O sulfato de níquel tem solubilidade moderada em água. Dissolve-se facilmente em água, sua solubilidade aumenta com o aumento da temperatura. A presença de outros íons e substâncias pode influenciar sua solubilidade. Além disso, o sulfato de níquel pode formar hidratos quando combinado com moléculas de água, levando à formação de vários hidratos de sulfato de níquel.
| Aparência | Cristais azuis/verdes |
| Gravidade Específica | 3,68 g/ml |
| Cor | Azul verde |
| Cheiro | Inodoro |
| Massa molar | 154,76 g/mol |
| Densidade | 3,68 g/ml |
| Ponto de fusão | 100°C (212°F) |
| Ponto de ebulição | Decomposto |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Muito solúvel |
| Solubilidade | Solúvel em água e solventes orgânicos como etanol |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | -1,1 (ácido sulfúrico) |
| pH | Ácido (cerca de 4) |
Segurança e perigos do sulfato de níquel
O sulfato de níquel apresenta certos riscos de segurança que precisam ser considerados. É essencial manuseá-lo com cuidado para evitar riscos potenciais. O contato direto com a pele deve ser minimizado, pois pode causar irritação ou sensibilização da pele. A ingestão ou inalação de sulfato de níquel deve ser evitada, pois pode causar efeitos adversos à saúde. Ao trabalhar com sulfato de níquel, deve-se usar equipamentos de proteção individual adequados, como luvas e óculos de proteção, para evitar o contato com a substância. O sulfato de níquel deve ser armazenado em local fresco e seco, longe de materiais incompatíveis. Ventilação adequada é necessária ao trabalhar com sulfato de níquel para minimizar a concentração de partículas transportadas pelo ar.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | – Evite contato com a pele – Evitar ingestão e inalação – Use equipamento de proteção pessoal apropriado |
| Identificadores das Nações Unidas | Não aplicável |
| Código SH | 2833,25 |
| Classe de perigo | Não classificado |
| Grupo de embalagem | Não aplicável |
| Toxicidade | Pode causar irritação ou sensibilização da pele |
Métodos de síntese de sulfato de níquel
Existem diferentes métodos para sintetizar sulfato de níquel.
Uma abordagem comum envolve a reação entre níquel metálico ou óxido de níquel com ácido sulfúrico . Neste método, o ácido sulfúrico dissolve o Ni metálico ou óxido de níquel, resultando na formação de sulfato de níquel. Você pode realizar a reação sob condições controladas, como temperatura e agitação, para garantir uma conversão eficiente.
Outro método envolve a reação do ácido sulfúrico com carbonato de níquel. O ácido sulfúrico dissolve o carbonato de níquel, produzindo sulfato de níquel. Os químicos normalmente usam esse método quando têm carbonato de níquel prontamente disponível, pois fornece um material de partida conveniente.
Além disso, o ácido sulfúrico pode dissolver o hidróxido de níquel para sintetizar NiSO4. A dissolução do hidróxido de níquel em ácido sulfúrico leva à formação de NiSO4. Este método é adequado quando se deseja utilizar hidróxido de níquel como precursor para a síntese de sulfato de níquel.
É importante observar que você deve seguir as devidas precauções de segurança durante o processo de síntese. Isso inclui o uso de equipamentos de proteção e procedimentos de manuseio adequados. Realize as reações em uma área bem ventilada para minimizar o risco de exposição a vapores nocivos. O controle cuidadoso dos parâmetros de reação, como temperatura e concentração, é crucial para garantir a conversão e o rendimento ideais do sulfato de níquel.
Usos do sulfato de níquel
O sulfato de níquel tem diversas aplicações em diferentes indústrias. Aqui estão alguns de seus usos comuns:
- Galvanoplastia: Os processos de galvanoplastia fazem uso extensivo de sulfato de níquel para criar um revestimento durável e resistente à corrosão em superfícies metálicas. O sulfato de níquel melhora a aparência, a dureza e a resistência de itens como joias, peças automotivas e utensílios de cozinha.
- Catalisador: O sulfato de níquel atua como catalisador em muitas reações químicas, incluindo processos de hidrogenação e oxidação. As indústrias utilizam catalisadores de sulfato de níquel na produção de produtos farmacêuticos, petroquímicos e de química fina.
- Baterias: As baterias recarregáveis, especialmente as baterias Ni-Cd e Ni-MH, contêm sulfato de níquel como componente essencial. O sulfato de níquel facilita as reações dos eletrodos e garante armazenamento e liberação eficientes de energia elétrica.
- Fertilizante: Alguns fertilizantes usam Ni solúvel do sulfato de níquel para fornecer nutrientes essenciais às plantas. O níquel desempenha um papel crucial em diversos processos metabólicos das plantas, contribuindo para o seu crescimento e desenvolvimento.
- Têxteis: A indústria têxtil utiliza sulfato de níquel em processos de tingimento e impressão para melhorar a solidez da cor e a absorção de corantes dos tecidos. O sulfato de níquel garante resultados de cores vibrantes e duradouros.
- Produtos farmacêuticos: O sulfato de níquel encontra aplicações em preparações farmacêuticas, principalmente para produzir medicamentos contendo Ni como ingrediente ativo ou para formular complexos específicos de Ni utilizados em pesquisas médicas.
- Pesquisa e desenvolvimento: Os laboratórios usam sulfato de níquel para diversos fins de pesquisa e desenvolvimento, incluindo síntese química, estudos eletroquímicos e pesquisa em ciência de materiais.
Questões:
P: Qual é a fórmula do sulfato de níquel (II)?
R: A fórmula do sulfato de níquel (II) é NiSO4.
Q: O cromo metálico é adicionado a uma solução de sulfato de níquel (II). Qual é a reação química balanceada?
R: A reação química balanceada é: Cr + NiSO4 -> CrSO4 + Ni.
P: Como fazer sulfato de níquel e amônio?
R: O sulfato de níquel amônio pode ser preparado dissolvendo o sulfato de níquel e o sulfato de amônio em água, seguido de cristalização.
P: O sulfato de níquel é solúvel em água?
R: Sim, o sulfato de níquel é solúvel em água.
P: Quem extrai sulfato de níquel?
R: O sulfato de níquel não é extraído diretamente. Minérios de níquel são extraídos e sulfato de níquel pode ser produzido a partir deles.
P: Qual é o nome do composto NiSO4?
R: O composto NiSO4 é chamado de sulfato de níquel.
P: Quantos gramas de NiSO4 existem em 100 g de hidrato? Quantos moles?
R: A quantidade de NiSO4 em 100 g de hidrato depende do composto hidratado específico e de sua massa molar.
P: O NiSO4 é solúvel em água?
R: Sim, NiSO4 é solúvel em água.
P: Quantos gramas de NiSO4 são obtidos se o rendimento for de 76,9%?
R: Os gramas de NiSO4 obtidos dependem da quantidade inicial e das condições de reação.
P: O NiSO4 é perigoso?
R: O NiSO4 pode ser perigoso se não for manuseado corretamente. É importante seguir as instruções de segurança ao trabalhar com ele.
P: Qual é o nome do composto covalente NiSO4?
R: NiSO4 não é um composto covalente. É um composto iônico chamado sulfato de níquel.
P: NiSO4 é um sal?
R: Sim, o NiSO4 é considerado um sal devido à sua natureza iônica e à sua formação a partir da reação entre um ácido (ácido sulfúrico) e uma base (hidróxido de níquel).
P: Qual é a carga do NiSO4?
R: No NiSO4, o íon níquel (Ni2+) carrega uma carga positiva de 2+, enquanto o íon sulfato (SO4 2-) carrega uma carga negativa de 2-.
