Sulfato de magnésio (sulfato) ou MgSo4 é um composto químico composto de magnésio, enxofre e oxigênio. É comumente usado medicinalmente como laxante, anticonvulsivante e para tratar a deficiência de magnésio.
| Nome IUPAC | Sulfato de magnésio |
| Fórmula molecular | MgSO4 |
| Número CAS | 7487-88-9 |
| Sinônimos | Sal Epsom; Sal inglês; Sal amargo; Sal de banho; Sal Epsom; Sal anglicum; Sulfato de magnésio heptahidratado |
| InChI | InChI=1S/Mg.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Fórmula de sulfato de magnésio
A fórmula química do sulfato de magnésio é MgSO4. Esta fórmula indica que o sulfato de magnésio é composto por um cátion magnésio (Mg2+) e um ânion sulfato (SO42-). A fórmula do sulfato de magnésio é importante nos cálculos químicos porque ajuda a determinar a quantidade de uma substância necessária em uma reação química.
Massa molar de MgSO4
A massa molar do sulfato de magnésio é 120,366 g/mol. Este valor é calculado somando as massas atômicas de um átomo de magnésio (24,305 g/mol), um átomo de enxofre (32,066 g/mol) e quatro átomos de oxigênio (15,999 g/mol cada). A massa molar é um parâmetro importante nos cálculos químicos porque ajuda a determinar a quantidade de uma substância necessária em uma reação química.
Ponto de ebulição do sulfato de magnésio
O ponto de ebulição do sulfato de magnésio depende do estado do composto. O sulfato de magnésio existe em duas formas, anidro e heptahidratado. A forma anidra tem um ponto de ebulição mais alto de 1,124 °C (2,055 °F), enquanto a forma heptahidratada tem um ponto de ebulição mais baixo de 150 °C (302 °F). O ponto de ebulição do sulfato de magnésio pode ser afetado por fatores como pressão e impurezas.
Ponto de fusão do sulfato de magnésio
O ponto de fusão do sulfato de magnésio também depende do estado do composto. A forma anidra tem um ponto de fusão mais alto de 1,124 °C (2,055 °F), enquanto a forma heptahidratada tem um ponto de fusão mais baixo de 150 °C (302 °F). O ponto de fusão do sulfato de magnésio também pode ser afetado por fatores como pressão e impurezas.
Densidade de sulfato de magnésio g/ml
A densidade do sulfato de magnésio varia dependendo do estado do composto. A forma anidra tem densidade de 2,66 g/cm³, enquanto a forma heptahidratada tem densidade de 1,68 g/cm³. Densidade é uma propriedade física de uma substância que indica a quantidade de massa por unidade de volume. A densidade do sulfato de magnésio pode ser usada para calcular o volume de uma substância necessária para uma reação química.
Peso molecular do sulfato de magnésio
O peso molecular do sulfato de magnésio é 120.366 g/mol. Este valor é calculado somando as massas atômicas de um átomo de magnésio (24,305 g/mol), um átomo de enxofre (32,066 g/mol) e quatro átomos de oxigênio (15,999 g/mol cada). O peso molecular é um parâmetro importante nos cálculos químicos porque ajuda a determinar a quantidade de uma substância necessária em uma reação química.
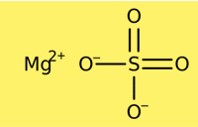
Estrutura do sulfato de magnésio
O sulfato de magnésio possui uma estrutura cristalina. A forma anidra possui estrutura cristalina romboédrica, enquanto a forma heptaidratada possui estrutura cristalina monoclínica. A estrutura cristalina do sulfato de magnésio é composta por cátions de magnésio e ânions sulfato. A forma anidra contém um cátion magnésio e um ânion sulfato por célula, enquanto a forma heptahidratada contém um cátion magnésio e dois ânions sulfato por célula.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 2,66 (anidro) 1,68 (heptahidrato) |
| Cor | Incolor a branco |
| Cheiro | Inodoro |
| Massa molar | 120.366 g/mol |
| Densidade | 2,66 g/cm³ (anidro) 1,68 g/cm³ (heptahidrato) |
| Ponto de fusão | 1124°C (anidro) 150°C (heptahidrato) |
| Ponto de ebulição | 1124°C (anidro) 150°C (heptahidrato) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 71,6g/100ml (20°C) |
| Solubilidade | Solúvel em água e etanol |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| PKa | 9,99 |
| pH | 6,0 – 8,0 (solução a 5%) |
Segurança e perigos do sulfato de magnésio
O sulfato de magnésio é geralmente considerado seguro quando manuseado corretamente. No entanto, pode representar certos perigos se não for manuseado com cuidado. A exposição ao pó de sulfato de magnésio pode irritar os olhos, a pele e o sistema respiratório. A ingestão ou injeção de grandes quantidades de sulfato de magnésio pode causar diarreia, cólicas estomacais e desidratação. É importante usar equipamentos de proteção, como luvas e óculos de proteção, ao manusear o sulfato de magnésio para evitar irritações na pele e nos olhos. Se ingerido ou exposto, procure atendimento médico imediatamente. O sulfato de magnésio deve ser armazenado em local fresco e seco, longe de fontes de calor e materiais incompatíveis.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | S22 – Não respirar as poeiras; S24/25 – Evitar contato com pele e olhos; S36 – Usar vestuário de proteção adequado; S26 – Em caso de contato com os olhos, lavar imediatamente com água em abundância e consultar um médico; S45 – Em caso de acidente ou indisposição, consulte imediatamente um médico (se possível mostre o rótulo ao médico) |
| Identificadores AN | UN3077 |
| Código SH | 28332100 |
| Classe de perigo | 9 |
| Grupo de embalagem | III |
| Toxicidade | LD50 (oral, rato) > 3.000 mg/kg; LD50 (cutâneo, rato) > 2.000 mg/kg |
Métodos de síntese de sulfato de magnésio
Existem diferentes métodos para sintetizar sulfato de magnésio (MgSO4).
Um método comum é reagir óxido de magnésio ou hidróxido de magnésio com ácido sulfúrico. O processo envolve a adição de óxido ou hidróxido de magnésio ao ácido sulfúrico enquanto se agita até que a mistura se dissolva completamente. Colete os cristais de magnésio MgSO4 evaporando a solução para remover o excesso de água.
Outra abordagem é adicionar lentamente carbonato de magnésio ao ácido sulfúrico enquanto agita até dissolver completamente. Para obter cristais de magnésio MgSO4, filtre a solução resultante para remover todas as impurezas e evapore-a.
Reaja o magnésio com ácido sulfúrico e aqueça a mistura até que a reação esteja completa, depois filtre e evapore a solução resultante para obter os cristais de magnésio MgSO4.
Você também pode obter MgSO4 de magnésio reagindo cloreto de magnésio com MgSO4 de sódio. O processo envolve adicionar cloreto de magnésio a uma solução de MgSO4 de sódio, agitar a mistura resultante e aquecê-la até que se formem cristais de MgSO4 de magnésio.
Usos do sulfato de magnésio
O sulfato de magnésio (MgSO4) tem muitas aplicações em diversos campos. Alguns de seus usos incluem:
- Usos Médicos: Usado como tratamento para eclâmpsia e pré-eclâmpsia durante a gravidez, bem como para prevenir convulsões em pacientes com asma grave ou hipomagnesemia. Serve como catártico e laxante.
- Agricultura: Utilizado como fertilizante devido ao seu alto teor de magnésio e enxofre. Os agricultores utilizam-no para corrigir deficiências de magnésio nos solos.
- Indústria de Alimentos e Bebidas: Usado como sal de cerveja na produção de cerveja para ajustar a química da água e melhorar o sabor. A indústria alimentícia o utiliza como coagulante na produção de tofu.
- Aplicações industriais: Utilizado como agente secante e dessecante, bem como retardador de chama. Várias indústrias o utilizam na fabricação de têxteis, papel e produtos químicos.
- Cuidados pessoais: As pessoas usam sulfato de magnésio em sais de banho e escalda-pés por seus alegados benefícios à saúde, incluindo redução de dores musculares e rigidez.
- Outros usos: Utilizado na produção de pigmentos, explosivos e na purificação de metais.
Questões:
P: Qual é a base usada na pasta de dente?
R: A base mais comumente usada em pasta de dente é geralmente carbonato de cálcio ou bicarbonato de sódio. Essas bases ajudam a esfregar os dentes e remover a placa bacteriana.
P: Para que é usado o sulfato de magnésio?
R: O sulfato de magnésio tem vários usos, inclusive como tratamento para eclâmpsia e pré-eclâmpsia durante a gravidez, como catártico e laxante, como fertilizante, como sal de cerveja, como retardador de fogo e como agente secante. Também é utilizado na fabricação de têxteis, papel e produtos químicos.
P: O sulfato de magnésio é solúvel?
R: O sulfato de magnésio é solúvel em água e álcool.
P: O sulfato de magnésio é solúvel em água?
R: Sim, o sulfato de magnésio é altamente solúvel em água, com solubilidade de aproximadamente 25,5 g/100 ml à temperatura ambiente.
P: Para que é usado o sulfato de magnésio?
R: O sulfato de magnésio tem vários usos e benefícios dependendo da aplicação específica. Alguns de seus usos incluem como tratamento médico, como fertilizante, como sal de fabricação de cerveja, como retardador de fogo e como agente secante. Medicinalmente, o sulfato de magnésio pode ser usado para prevenir convulsões, tratar a constipação e reduzir a dor e rigidez muscular.
