O sulfato de ferro (ii) é um composto químico que contém íons de ferro e sulfato. É comumente usado no tratamento de água e como suplemento nutricional para plantas.
| Nome IUPAC | Sulfato de ferro (II) |
| Fórmula molecular | FeSO4 |
| Número CAS | 7720-78-7 |
| Sinônimos | Sulfato ferroso, sulfato de ferro, vitríolo verde, melanterita, szomolnokite |
| InChI | InChI=1S/Fe.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Propriedades do sulfato de ferro (ii)
Fórmula de sulfato de ferro (II)
A fórmula química do sulfato de ferro (II) é FeSO4. Esta fórmula indica que o sulfato ferroso consiste em um átomo de ferro, um átomo de enxofre e quatro átomos de oxigênio. A fórmula do sulfato ferroso é um parâmetro importante para o cálculo de diversas propriedades físicas e químicas do composto, como massa molar e peso molecular.
Sulfato de Ferro(II) Massa molar
A massa molar do sulfato ferroso é 151,91 g/mol. Este valor representa a massa de um mol de sulfato ferroso, que contém 1 átomo de ferro, 1 molécula de enxofre e 4 moléculas de oxigênio. A massa molar é um parâmetro importante para o cálculo de diversas propriedades físicas e químicas do sulfato ferroso, como densidade e concentração.
Ponto de ebulição do sulfato de ferro (II)
O sulfato ferroso não possui ponto de ebulição específico porque sofre decomposição antes de atingir seu ponto de ebulição. À pressão atmosférica, começa a se decompor por volta de 300°C. Essa decomposição envolve a perda de água e trióxido de enxofre, deixando para trás o óxido de ferro (III). Este comportamento de decomposição limita o uso de sulfato ferroso em aplicações de alta temperatura.
Ponto de fusão de sulfato de ferro (II)
O ponto de fusão do sulfato ferroso depende do grau de hidratação. O sulfato ferroso anidro funde a 695°C, enquanto as formas heptahidratadas fundem a 64°C. O sulfato ferroso pode existir em diversas formas hidratadas diferentes, cada uma com um ponto de fusão diferente. O ponto de fusão do sulfato ferroso é um parâmetro importante na determinação das melhores condições de preparação e manuseio do composto.
Densidade de sulfato de ferro (II) g/mL
A densidade do sulfato ferroso varia dependendo do grau de hidratação. O sulfato ferroso anidro tem densidade de 3,65 g/mL, enquanto a forma heptahidratada tem densidade de 1,897 g/mL. A densidade do sulfato ferroso é um parâmetro importante para calcular o volume de uma determinada massa do composto.
Peso molecular do sulfato de ferro (II)
O peso molecular do sulfato ferroso é 151,91 g/mol. Este valor representa a soma dos pesos atômicos dos átomos constituintes de uma molécula de sulfato ferroso. O peso molecular é um parâmetro importante para o cálculo de diversas propriedades físicas e químicas do sulfato ferroso, como ponto de ebulição e solubilidade.
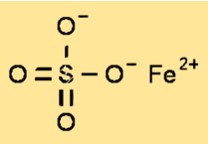
Estrutura do sulfato de ferro (II)
O sulfato ferroso possui uma estrutura cristalina que pertence ao sistema monoclínico. A estrutura cristalina do sulfato ferroso consiste em cátions de ferro (II) rodeados por seis moléculas de água e ânions sulfato. A estrutura cristalina do sulfato ferroso é um parâmetro importante para a compreensão das propriedades físicas e químicas do composto.
| Aparência | Pó cristalino branco ou verde pálido |
| Gravidade Específica | 3,65 g/cm3 (anidro) |
| Cor | Verde pálido |
| Cheiro | Inodoro |
| Massa molar | 151,91 g/mol |
| Densidade | 3,65 g/cm3 (anidro), 1,89 g/cm3 (heptahidrato) |
| Ponto de fusão | 695°C (anidro), 64°C (heptahidrato) |
| Ponto de ebulição | Decompõe-se antes de atingir o ponto de ebulição |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Muito solúvel |
| Solubilidade | Solúvel em água, insolúvel em etanol |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | 4 (solução 0,1M) |
Segurança e perigos do sulfato de ferro (ii)
O sulfato ferroso pode representar certos riscos à saúde e segurança humanas. Pode causar irritação e vermelhidão na pele e nos olhos em contato, e a inalação de sua poeira pode causar irritação no trato respiratório. A ingestão pode causar dor abdominal, náusea, vômito e diarréia. Além disso, a exposição ao sulfato ferroso pode causar asma ocupacional e pneumonite de hipersensibilidade em indivíduos suscetíveis. É importante seguir os procedimentos adequados de manuseio e armazenamento, usar equipamento de proteção individual adequado e evitar inalar ou ingerir o composto. Em caso de exposição acidental, procure imediatamente assistência médica e consulte a ficha de dados de segurança para aconselhamento.
| Símbolos de perigo | Xn,N |
| Descrição de segurança | Manter afastado de umidade, ácidos e agentes oxidantes. Evite contato com a pele, olhos e roupas. Não ingira. Use com ventilação adequada. Lave bem as mãos após o manuseio. |
| Números de identificação da ONU | ONU3077, ONU1376 |
| Código SH | 2833.29.90 |
| Classe de perigo | 9 (mercadorias perigosas diversas) |
| Grupo de embalagem | III |
| Toxicidade | Nocivo se ingerido, causa irritação na pele e nos olhos, pode causar irritação no trato respiratório. Pode causar sensibilização por inalação ou contato com a pele. |
Métodos para a síntese de sulfato de ferro (ii)
Existem vários métodos para sintetizar sulfato ferroso.
Um método comum envolve a reação de depósitos de ferro com ácido sulfúrico na presença de água e oxigênio. Isto produz uma solução de sulfato ferroso hepta-hidratado, que pode ser posteriormente purificada por cristalização.
Outro método envolve a reação do óxido de ferro com ácido sulfúrico em alta temperatura, seguida de resfriamento e filtração da solução resultante.
Um agente redutor, como pó de ferro ou dióxido de enxofre, pode reduzir o sulfato de ferro (III) a sulfato ferroso. Isto produz sulfato ferroso e ácido sulfúrico . Para preparar sulfato ferroso, o ferro pode reagir com dióxido de enxofre e oxigênio na presença de água.
Outro método envolve a reação do ferro com ácido sulfúrico diluído na presença de peróxido de hidrogênio . Isso produz sulfato ferroso e água.
Usos do sulfato de ferro (ii)
O sulfato de ferro (II) tem uma ampla gama de aplicações em diversos setores, incluindo:
- Tratamento de Água: Comumente usado no tratamento de água para remover impurezas, como sulfeto de hidrogênio, da água.
- Fertilizantes: Utilizados na produção de fertilizantes para fornecer às plantas nutrientes essenciais de ferro.
- Produção de pigmentos: utilizado como precursor para a produção de diversos pigmentos de óxido de ferro, como pigmentos amarelos e marrons.
- Suplementos Nutricionais: Usados como suplemento nutricional para tratar anemia por deficiência de ferro em humanos e animais.
- Tratamento de águas residuais: Usado no tratamento de águas residuais para remover fosfato e outros contaminantes.
- Produção de tinta: utilizado na produção de tinta como agente escurecido.
- Preservativos de madeira: Usados como preservativos de madeira para proteger a madeira do ataque de fungos e insetos.
- Reagente de Laboratório: Utilizado como reagente de laboratório em diversas reações e análises químicas.
Questões:
O sulfato de ferro é solúvel em água?
R: O sulfato de ferro, também conhecido como sulfato ferroso, é moderadamente solúvel em água.
P: Qual é a fórmula do composto sulfato de ferro (ii)?
R: A fórmula do sulfato ferroso é FeSO4.
P: Qual é a fórmula química do sulfato de ferro (ii)?
R: A fórmula química do sulfato ferroso é FeSO4.
P: Qual é a porcentagem de enxofre no sulfato de ferro (ii)?
R: A porcentagem de enxofre no sulfato ferroso é de 18,5%.
P: O sulfato de ferro (ii) é solúvel em água?
R: Sim, o sulfato de ferro II, também conhecido como sulfato ferroso, é solúvel em água.
P: O que é sulfato ferroso?
R: Sulfato ferroso é outro nome para sulfato ferroso, um composto químico comumente usado em diversas indústrias.
P: Para que é usado o sulfato ferroso?
R: O sulfato ferroso é usado para diversos fins, incluindo tratamento de água, produção de fertilizantes, produção de pigmentos, suplementos nutricionais, produção de tintas, conservantes de madeira e reagentes corantes. laboratório.
