O sulfato de cobre é um sólido cristalino azul com a fórmula CuSO4. É comumente utilizado na agricultura, como fungicida e na produção de corantes e pigmentos.
| Nome IUPAC | Sulfato de cobre (II) |
| Fórmula molecular | CuSO4 |
| Número CAS | 7758-98-7 |
| Sinônimos | Vitriol azul, sulfato de cobre, sulfato de cobre, sal de cobre (2+) de ácido sulfúrico, sulfato de cobre (II), vitríolo de cobre, pedra azul |
| InChI | InChI=1S/Cu.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Massa molar de sulfato de cobre
O sulfato de cobre tem massa molar de 159.609 g/mol para a forma anidra (CuSO4) e 249.685 g/mol para a forma pentahidratada (CuSO4·5H2O). Massa molar é a soma das massas atômicas de todos os átomos de uma molécula. A massa molar do sulfato de cobre é calculada adicionando a massa atômica de um átomo de cobre (Cu), um átomo de enxofre (S) e quatro átomos de oxigênio (O) na forma anidra, ou adicionando a massa molar da forma anidra com o massa molar de cinco moléculas de água (H2O) na forma pentahidratada.
Ponto de ebulição do sulfato de cobre
O sulfato de cobre não possui ponto de ebulição específico porque se decompõe antes de atingir seu ponto de ebulição. No entanto, a forma pentahidratada do sulfato de cobre perderá moléculas de água quando aquecida, resultando em sulfato de cobre anidro, que se decompõe a aproximadamente 650°C. A decomposição do sulfato de cobre é um processo endotérmico, o que significa que absorve calor.
Ponto de fusão do sulfato de cobre
O sulfato de cobre tem um ponto de fusão de 110°C para a forma pentahidratada e 650°C para a forma anidra. O ponto de fusão é a temperatura na qual uma substância sólida passa para o estado líquido. A forma pentahidratada do sulfato de cobre derrete a uma temperatura mais baixa do que a forma anidra devido à presença de moléculas de água, que podem romper as ligações iônicas entre os átomos de cobre, enxofre e oxigênio.
Densidade de sulfato de cobre g/ml
O sulfato de cobre tem densidade de 3,6 g/mL para a forma anidra e 2,284 g/mL para a forma pentahidratada. Densidade é a medida de massa por unidade de volume. A densidade do sulfato de cobre é afetada pelo número de moléculas de água em sua estrutura, pois a forma pentahidratada contém mais moléculas de água por unidade de volume do que a forma anidra.
Peso molecular do sulfato de cobre
O sulfato de cobre tem peso molecular de 159.609 g/mol para a forma anidra e 249.685 g/mol para a forma pentahidratada. O peso molecular é a soma dos pesos atômicos de todos os átomos de uma molécula. O peso molecular do sulfato de cobre é usado em reações químicas e cálculos estequiométricos para determinar a quantidade de sulfato de cobre necessária ou produzida.
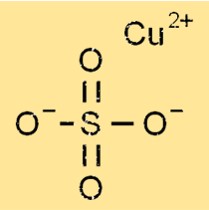
Estrutura do sulfato de cobre
O sulfato de cobre tem uma estrutura octaédrica nas formas anidra e pentahidratada, onde um átomo de cobre é cercado por quatro átomos de oxigênio e dois átomos de enxofre. Na forma pentahidratada, cinco moléculas de água estão ligadas à estrutura octaédrica, formando uma rede cristalina hidratada. As ligações iônicas entre moléculas de cobre, enxofre, oxigênio e água resultam na estrutura cristalina do sulfato de cobre.
Fórmula de sulfato de cobre
A fórmula do sulfato cúprico é CuSO4, o que indica que ele é composto por um átomo de cobre (Cu), um átomo de enxofre (S) e quatro átomos de oxigênio (O). Também é comumente conhecido como sulfato de cobre (II) ou Vitríolo Azul. A fórmula indica o número de átomos de cada elemento presente em uma molécula.
| Aparência | Sólido cristalino azul |
| Gravidade Específica | 3,6 (anidro); |
| Cor | Azul |
| Cheiro | Inodoro |
| Massa molar | 159.609 g/mol (anidro); |
| Densidade | 3,6 g/mL (anidro); |
| Ponto de fusão | 110°C (penta-hidrato); |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 31,6g/100ml (20°C) |
| Solubilidade | Solúvel em metanol, glicerol, ligeiramente solúvel em etanol, insolúvel em éter |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | 1,99 |
| pH | 3,5 – 4,5 |
Segurança e perigos do sulfato de cobre
O sulfato de cobre pode representar riscos à saúde se não for manuseado adequadamente. É prejudicial se ingerido e pode causar irritação ou queimaduras se entrar em contacto com a pele ou os olhos. A inalação de poeira ou vapor pode causar irritação ou danos respiratórios. É também um perigo potencial para o meio ambiente e pode ser tóxico para a vida aquática. Devem ser tomadas precauções ao manusear o sulfato de cobre, como usar roupas de proteção, luvas e óculos de proteção. Se ingerido, entre em contato com um centro de controle de intoxicações ou procure atendimento médico imediatamente. Em caso de contacto com a pele ou olhos, lavar com água durante vários minutos e consultar um médico.
| Símbolos de perigo | Xi (irritante) |
| Descrição de segurança | Evitar o contato com a pele e os olhos. Use luvas de proteção e proteção para os olhos/face. Se ingerido, consulte um médico. |
| Identificadores AN | UN3077 (para anidro); UN1512 (para pentahidrato) |
| Código SH | 2833.25.00 |
| Classe de perigo | 9 (Mercadorias perigosas diversas) |
| Grupo de embalagem | III |
| Toxicidade | Pode ser prejudicial se ingerido, causa irritação na pele e nos olhos e pode causar irritação no trato respiratório. |
Métodos de síntese de sulfato de cobre
Para sintetizar o sulfato de cobre, podem-se utilizar vários métodos, como a reação do cobre com ácido sulfúrico ou óxido de cobre ou hidróxido de cobre com ácido sulfúrico.
Para sintetizar o sulfato de cobre usando o primeiro método, o cobre é adicionado a um recipiente de reação contendo ácido sulfúrico e o calor é aplicado para iniciar a reação. O cobre reage com o ácido sulfúrico, resultando na produção de sulfato de cobre e água. Depois disso, a mistura resultante é resfriada e filtrada para separar os cristais de sulfato de cobre da solução restante.
Para sintetizar sulfato de cobre, pode-se reagir óxido de cobre ou hidróxido de cobre com ácido sulfúrico em um recipiente de reação. Após a reação, a mistura é resfriada e os cristais de sulfato de cobre são filtrados da solução restante.
Outro método envolve a reação do cobre com dióxido de enxofre e oxigênio em um recipiente de reação. A reação produz sulfato de cobre e água. A mistura resultante é resfriada e filtrada para obter os cristais de sulfato de cobre.
Para produzir sulfato de cobre, pode-se utilizar o método de eletrólise. Neste processo, uma solução aquosa de sulfato de cobre sofre eletrólise, resultando na deposição de sulfato de cobre no ânodo. Em seguida, os cristais de sulfato de cobre são separados da solução e secos.
Usos do sulfato de cobre
Alguns dos usos comuns do sulfato de cobre incluem:
- Utilizado como fertilizante para fornecer cobre ao solo, essencial para o crescimento das plantas. Usado como pesticida para controlar doenças fúngicas nas plantações.
- Adicionado à alimentação animal como fonte de cobre, necessário ao crescimento e desenvolvimento animal.
Indústria
- Utilizado em galvanoplastia para depositar cobre na superfície de outros metais, o que melhora sua resistência à corrosão.
- Usado no tratamento de água como algicida e floculante para remover algas e outras impurezas da água.
- Utilizado em química analítica como reagente para determinação de açúcares redutores e proteínas.
- Utilizado na indústria têxtil como mordente para fixar corantes nos tecidos e dar-lhes uma cor mais vibrante.
- Utilizado na indústria farmacêutica como fonte de cobre para suplementos nutricionais e medicamentos.
- Também utilizado na produção de pigmentos, tintas e tintas, bem como na fabricação de baterias, catalisadores e conservantes de madeira.
Questões:
P: O sulfato de cobre é solúvel em água?
R: Sim, o sulfato de cobre é altamente solúvel em água. À temperatura ambiente pode dissolver-se em água até um máximo de 203 gramas por 100 mililitros de água.
P: Onde comprar sulfato de cobre perto de mim?
R: O sulfato de cobre está prontamente disponível para compra na maioria das lojas de ferragens, centros de jardinagem e varejistas online. Você também pode verificar em sua loja local de suprimentos agrícolas ou de rações, pois o sulfato de cobre é comumente usado na agricultura e na alimentação animal.
P: Quanto sulfato de cobre por galão de água?
R: A quantidade de sulfato de cobre necessária por galão de água depende da aplicação específica. Por exemplo, na agricultura, a taxa de aplicação recomendada é geralmente entre 1 e 10 libras por acre. No tratamento de água, a dose recomendada é geralmente entre 0,2 e 1,0 miligramas por litro de água. É importante seguir cuidadosamente as instruções no rótulo do produto de sulfato de cobre para garantir o uso adequado.
P: Qual é a fórmula do sulfato de cobre (ii)?
R: A fórmula do sulfato de cobre (II) é CuSO4.
