O sulfato de alumínio é um sal inorgânico comumente usado como agente coagulante em processos de tratamento de água e como agente floculante na purificação de líquidos.
| Nome IUPAC | Sulfato de alumínio |
| Fórmula molecular | Al2(SO4)3 |
| Número CAS | 10043-01-3 |
| Sinônimos | Sulfato de alumínio, sulfato de diaalumínio, alúmen de bolo, alúmen de fábrica de papel, alúmen de filtro |
| InChI | InChI=1S/2Al.3H2O.14H2SO4/c;;31-5(2,3)4/h;;(H2,1,2,3,4)/q2+3;/p-3 |
Fórmula de sulfato de alumínio
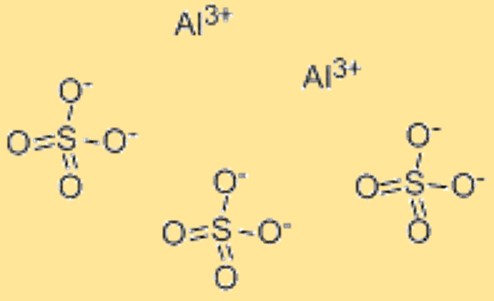
A fórmula química do sulfato de alumínio é Al2(SO4)3. Esta fórmula representa a proporção de átomos no sulfato de alumínio e é usada para indicar a composição do composto. A fórmula também pode ser usada em cálculos químicos, como na determinação da massa molar ou do número de moles de sulfato de alumínio em uma determinada amostra. A fórmula química do sulfato de alumínio fornece uma maneira conveniente de representar a composição do material e é amplamente reconhecida na comunidade científica. Além disso, a fórmula pode ser usada para prever as propriedades químicas e físicas do sulfato de alumínio, como sua solubilidade em água, sua reatividade com outros compostos e sua estabilidade sob diferentes condições.
Massa molar de sulfato de alumínio
A massa molar do sulfato de alumínio é 342,15 g/mol. Este valor é importante em vários cálculos químicos e físicos, incluindo a determinação de concentrações molares, a estequiometria das reações e a lei dos gases ideais. A massa molar é calculada somando os pesos atômicos de todos os átomos da fórmula química do sulfato de alumínio, que é Al2(SO4)3. A massa molar também pode ser usada para converter a massa em número de moles para uma determinada amostra de sulfato de alumínio.
Ponto de ebulição do sulfato de alumínio
O ponto de ebulição do sulfato de alumínio não está bem definido porque ele se decompõe antes de ferver. O sulfato de alumínio é um sal hidratado e quando aquecido perde a água de hidratação e se decompõe em óxido de alumínio e ácido sulfúrico. A temperatura de decomposição pode variar de 120°C a 140°C, dependendo do grau de hidratação. A presença de impurezas na amostra também pode afetar a temperatura de decomposição.
Ponto de fusão do sulfato de alumínio
O ponto de fusão do sulfato de alumínio é de aproximadamente 1200°C. Esta alta temperatura se deve às fortes ligações iônicas entre os íons alumínio e enxofre. O sulfato de alumínio é um sólido cristalino à temperatura ambiente e possui uma estrutura cristalina bem definida, o que contribui para seu alto ponto de fusão. O ponto de fusão do sulfato de alumínio é importante na determinação das condições de processamento necessárias para a síntese e purificação do material.
Densidade de sulfato de alumínio g/ml
A densidade do sulfato de alumínio é de 1,8 a 2,0 g/mL. Este valor pode variar dependendo do grau de hidratação e da presença de impurezas na amostra. A densidade do sulfato de alumínio é uma propriedade física importante que pode ser usada para calcular o volume de uma determinada massa do material. A densidade do sulfato de alumínio também é útil na determinação da concentração de uma solução, pois permite calcular a massa de soluto por unidade de volume de solvente.
Peso molecular do sulfato de alumínio
Determinamos que o peso molecular do sulfato de alumínio é 342,15 g/mol adicionando os pesos atômicos de todos os átomos em sua fórmula química Al2(SO4)3. Este valor serve tanto como peso molecular quanto como massa molar e desempenha um papel crucial em cálculos químicos, incluindo a determinação de concentrações molares e estequiometria de reação.
Estrutura de sulfato de alumínio
O sulfato de alumínio possui uma estrutura cristalina composta por cátions de alumínio (Al3+) e ânions sulfato (SO4^2-). Os cátions de alumínio coordenam-se com seis ânions sulfato em um arranjo hexagonal compacto, mantidos juntos por fortes ligações iônicas. A estrutura cristalina do sulfato de alumínio influencia suas propriedades físicas, como ponto de fusão e solubilidade.
| Aparência | Sólido cristalino |
| Gravidade Específica | 1,8 a 2,0g/ml |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 342,15 g/mol |
| Densidade | 1,8 a 2,0g/ml |
| Ponto de fusão | 770°C |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Solúvel em água |
| Solubilidade | Solúvel em água |
| Pressão de vapor | Não está bem definido |
| Densidade do vapor | Não está bem definido |
| pKa | Não está bem definido |
| pH | Neutro |
Segurança e perigos do sulfato de alumínio
O sulfato de alumínio é uma substância perigosa que deve ser manuseada com cuidado. A inalação de sua poeira pode causar irritação do trato respiratório e tosse. O contato com a pele ou os olhos pode causar vermelhidão, coceira e sensação de queimação. A ingestão de sulfato de alumínio pode causar irritação gastrointestinal, incluindo náuseas, vômitos e diarreia. Se ingerido em grandes quantidades, pode causar problemas de saúde mais graves, como depressão do sistema nervoso central e danos renais. Portanto, é importante utilizar equipamentos de proteção individual, como luvas e óculos de proteção, ao manusear o sulfato de alumínio. Além disso, a área de trabalho deve ser bem ventilada para reduzir o risco de inalação de poeira. Em caso de contato com a pele ou olhos, a área afetada deve ser enxaguada com água em abundância por pelo menos 15 minutos e procurar atendimento médico imediatamente.
| Símbolos de perigo | Xi – Irritante |
| Descrição de segurança | S24/25 – Evitar contato com pele e olhos |
| Identificadores AN | UN3077 – Perigo ambiental |
| Código SH | 2833.30.00 |
| Classe de perigo | 8 – Substância corrosiva |
| Grupo de embalagem | III |
| Toxicidade | Toxicidade baixa a moderada se ingerido, inalado ou em contato com a pele ou os olhos |
Métodos de síntese de sulfato de alumínio
O sulfato de alumínio pode ser sintetizado por vários métodos, incluindo precipitação e reação com ácido sulfúrico.
Um método de síntese é o método de precipitação, que envolve a mistura de uma solução de sais de alumínio com ácido sulfúrico. Esta reação resulta na formação de sulfato de alumínio, que precipita da solução na forma sólida. O sólido pode então ser filtrado, lavado e seco para obter sulfato de alumínio puro.
Outro método de síntese é o método de reação, que envolve a mistura de hidróxido de alumínio ou óxido de alumínio com ácido sulfúrico. Esta reação resulta na formação de sulfato de alumínio e água. O produto pode então ser purificado por lavagem e secagem.
Em ambos os métodos, a pureza do produto final pode ser melhorada utilizando materiais de partida de elevada pureza e controlando cuidadosamente as condições de reacção. A pureza do sulfato de alumínio pode ser verificada analisando suas propriedades físicas e químicas, como massa molar, ponto de fusão e solubilidade em água.
No geral, a síntese do sulfato de alumínio é um processo relativamente simples que pode ser realizado em laboratório ou em ambiente industrial, dependendo da escala de produção desejada. A escolha do método de síntese dependerá da disponibilidade de matéria-prima, da pureza desejada do produto e da escala de produção desejada.
Usos do sulfato de alumínio
As indústrias utilizam o sulfato de alumínio por sua versatilidade em diversas aplicações como tratamento de água, produção de papel e agricultura. No tratamento de água, a substância atua como coagulante e purifica a água potável, fazendo com que as impurezas se agreguem e formem partículas maiores que podem ser facilmente filtradas. A indústria de produção de papel utiliza sulfato de alumínio como carga e aglutinante para melhorar a resistência e o brilho do papel e regular os níveis de pH na polpa. Na agricultura, o sulfato de alumínio reduz o pH do solo e aumenta a acidez, fornecendo às plantas nutrientes essenciais como enxofre e alumínio. O sulfato de alumínio também tem outros usos, incluindo curtimento de couro, têxteis à prova de fogo e como floculante no tratamento de águas residuais. Assim, o sulfato de alumínio desempenha um papel importante na vida moderna, atendendo a diversas finalidades em diversos setores.
Questões:
Qual é a fórmula do sulfato de alumínio?
A fórmula química do sulfato de alumínio é Al2(SO4)3.
O sulfato de alumínio é solúvel?
Sim, o sulfato de alumínio é solúvel em água. Dissolve-se em água para formar uma solução de íons alumínio, sulfato e hidróxido. A solubilidade do sulfato de alumínio em água depende da temperatura, o que significa que é mais solúvel em temperaturas mais altas e menos solúvel em temperaturas mais baixas. À temperatura ambiente, o sulfato de alumínio é facilmente solúvel em água, com solubilidade de aproximadamente 20 gramas por 100 mililitros de água.
