O persulfato de amônio ((NH4)2S2O8) é um pó branco. Dissolve-se em água e libera oxigênio. Pode branquear, condicionar ou iniciar a polimerização.
| Nome da IUPAC | Peroxidissulfato de amônio |
| Fórmula molecular | (NH4)2S2O8 |
| Número CAS | 7727-54-0 |
| Sinônimos | Persulfato de amônio, peroxodissulfato de amônio, persulfato de diamônio, peroxidissulfato de diamônio |
| InChI | InChI=1S/2H3N.H2O8S2/c;;1-9(2,3)7-8-10(4,5)6/h2*1H3;(H,1,2,3)(H,4,5 ,6) |
Propriedades do persulfato de amônio
Fórmula de Persulfato de Amônio
A fórmula do persulfato de amônio é (NH4)2S2O8. Consiste em dois cátions de amônio (NH4+) e um ânion persulfato (S2O82-). O ânion persulfato possui dois grupos sulfato (SO42-) conectados por uma ligação peróxido (OO).
Massa molar de persulfato de amônio
A massa molar de (NH4)2S2O8 é 228,18 g/mol. Isso é calculado adicionando as massas atômicas de todos os átomos na fórmula: 2 x 14,01 (N) + 8 x 1,01 (H) + 2 x 32,06 (S) + 8 x 16,00 (O).
Ponto de ebulição do persulfato de amônio
(NH4)2S2O8 não tem ponto de ebulição porque se decompõe antes de atingir esta temperatura. Ele se decompõe a aproximadamente 120°C (248°F) em amônia, nitrogênio, oxigênio e água. A reação de decomposição é:
(NH4)2S2O8 -> 2NH3 + N2 + O2 + 2H2O
Ponto de fusão do persulfato de amônio
(NH4)2S2O8 não tem ponto de fusão porque se decompõe antes de atingir esta temperatura. Ele se decompõe a aproximadamente 120°C (248°F) em amônia, nitrogênio, oxigênio e água. A reação de decomposição é:
(NH4)2S2O8 -> 2NH3 + N2 + O2 + 2H2O
Densidade de persulfato de amônio g/mL
A densidade de (NH4)2S2O8 é 1,98 g/mL a 25°C. Isto significa que um mililitro de (NH4)2S2O8 pesa 1,98 gramas.
Peso molecular do persulfato de amônio
O peso molecular de (NH4)2S2O8 é igual à sua massa molar, que é 228,18 g/mol. Isso significa que um mol de (NH4)2S2O8 pesa 228,18 gramas.
Estrutura do persulfato de amônio
A estrutura de (NH4)2S2O8 pode ser representada pela seguinte estrutura de Lewis:
OO
|| ||
O=S||-OOS||=O
|| ||
OO
/\
NH NH
\/
H
/\
NH NH
\/
H
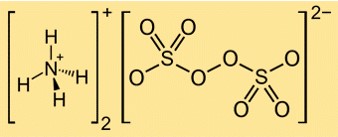
Nesta estrutura, cada átomo de enxofre está ligado a quatro átomos de oxigênio em uma geometria tetraédrica, e cada átomo de oxigênio possui dois pares de elétrons livres. A ligação peróxido entre os dois grupos sulfato é uma ligação simples com um par de elétrons. Os cátions de amônio são formados a partir de átomos de nitrogênio que compartilham três elétrons com três átomos de hidrogênio cada e possuem carga positiva.
Solubilidade do persulfato de amônio
(NH4)2S2O8 é muito solúvel em água, muito mais que o sal de potássio associado 1 . Dissolve-se em água para formar íons de amônio e íons persulfato, que podem se dissociar ainda mais em radicais sulfato:
(NH4)2S2O8 -> 2NH4+ + S2O82-
S2O82- -> 2 SO4•-
A solubilidade de (NH4)2S2O8 em água aumenta com o aumento da temperatura. A 25°C pode dissolver até 80g/100ml de água. Também é moderadamente solúvel em metanol.
| Aparência | Cristais brancos a amarelados |
| Densidade específica | 1,98 |
| Cor | Branco a amarelado |
| Cheiro | Doce e desagradável |
| Massa molar | 228,18 g/mol |
| Densidade | 1,98 g/mL a 25°C |
| Ponto de fusão | 120°C (decompõe-se) |
| Ponto de ebulição | N/A (decomposto) |
| Ponto flash | N / D |
| Solubilidade em Água | 80 g/100 mL a 25°C |
| Solubilidade | Moderadamente solúvel em MeOH |
| Pressão de vapor | N / D |
| Densidade do vapor | N / D |
| pKa | N / D |
| pH | N / D |
Segurança e perigos do persulfato de amônio
(NH4)2S2O8 é um forte agente oxidante que pode intensificar o fogo e reagir de forma explosiva com materiais combustíveis. Também pode causar vários efeitos à saúde se ingerido, inalado ou em contato com a pele ou os olhos. Pode irritar a pele, olhos, nariz, garganta e pulmões. Também pode causar reações alérgicas, como erupção na pele, asma ou dificuldade em respirar. É prejudicial à vida aquática. Portanto, deve ser manuseado com cuidado e com equipamento de proteção adequado. Deve ser armazenado longe de calor, faíscas, chamas e quaisquer outras substâncias incompatíveis.
| Símbolos de perigo | O (oxidante), Xn (nocivo), Xi (irritante) |
| Descrição de segurança | S17 (Manter afastado de materiais combustíveis), S26 (Em caso de contacto com os olhos, lavar imediata e abundantemente com água e consultar um médico), S36/37/39 (Usar vestuário de protecção, luvas e protecção ocular/facial adequados), S45 (Em caso de acidente ou indisposição, procure atendimento médico imediatamente) |
| Números de identificação da ONU | ONU 1444 |
| Código SH | 28334000 |
| Classe de perigo | 5.1 (Materiais oxidantes) |
| Grupo de embalagem | III |
| Toxicidade | Rato LD50 oral: 689 mg/kg, rato por inalação LC50: 2,95 mg/L/4h, rato LD50 dérmico: 2.000 mg/kg |
Métodos para a síntese de persulfato de amônio
Vários métodos podem ser usados para preparar (NH4)2S2O8, que é um sal inorgânico.
Um dos métodos mais comuns envolve a eletrólise de uma solução fria e concentrada de sulfato de amônio ((NH4)2SO4) e ácido sulfúrico (H2SO4) .
Este método foi descrito pela primeira vez por Hugh Marshall. A eletrólise envolve a passagem de uma corrente elétrica através da solução usando um ânodo de platina e um cátodo de prata poroso.
No ânodo, a eletrólise do ácido sulfúrico produz íons sulfato de hidrogênio HSO4-, que se combinam com a água para criar íons persulfato S2O82- e gás hidrogênio H2. No cátodo, o gás oxigênio O2 sofre redução para produzir peróxido de hidrogênio H2O2, que reage com íons de amônio NH4+ para formar (NH4)2S2O8 (NH4)2S2O8 e água H2O.
A reação geral é a seguinte:
(NH4)2SO4 + 2 H2SO4 -> (NH4)2S2O8 + 2 H2O + H2 + O2
Ao resfriar e filtrar, (NH4)2S2O8 pode ser cristalizado a partir da solução eletrolítica.
Outro método de preparação de (NH4)2S2O8 é a oxidação do bissulfato de amônio NH4HSO4 com ozônio O3 ou peróxido de hidrogênio H2O2 . Este método produz maior rendimento e pureza de (NH4)2S2O8 do que o método de eletrólise. A reação é:
NH4HSO4 + O3 -> (NH4)2S2O8 + H2O
Ouro
NH4HSO4 + H2O2 -> (NH4)2S2O8 + 2H2O
Usos do persulfato de amônio
(NH4)2S2O8 é um produto químico versátil que tem muitos usos em diversas indústrias e aplicações. Alguns dos usos mais comuns são:
- Serve como agente de branqueamento e precursor químico na síntese de outros compostos industrialmente importantes.
- Ele inicia o processo de polimerização e os fabricantes o utilizam principalmente na produção de poliestireno.
- Os fabricantes de PCB o utilizam como agente de ataque para remover cobre e outros metais da superfície.
- A indústria de semicondutores também usa (NH4)2S2O8 como agente de ataque para limpar e polir pastilhas de silício.
- Os laboratórios utilizam-no como agente de limpeza e desinfetante para equipamentos, vidrarias e sistemas de água.
- Evita o escurecimento de frutas e vegetais, sendo um aditivo utilizado para conservar alimentos.
- Diversas reações químicas utilizam-no como agente oxidante para a síntese de peróxidos orgânicos, sulfonas e sulfonamidas.
- As baterias o utilizam como despolarizador para aumentar seu desempenho e vida útil.
- Os descolorantes de cabelo o utilizam como ingrediente comum para clarear a cor do cabelo, oxidando o pigmento melanina.
Questões:
P: Quanto tempo dura o persulfato de amônio?
R: (NH4)2S2O8 é um composto estável que pode ser armazenado indefinidamente no estado sólido sem decomposição. No entanto, pode perder a sua eficácia ao longo do tempo quando dissolvido em água. A vida útil de uma solução de (NH4)2S2O8 a 10% é de aproximadamente 2 a 4 semanas à temperatura ambiente e 2 a 3 meses a 4°C 1 2 . A solução deve ser protegida da luz e do calor e verificada periodicamente quanto à presença de bolhas ou precipitados indicando decomposição.
P: O que o persulfato de amônio faz?
R: (NH4)2S2O8 é um forte agente oxidante que pode liberar radicais de oxigênio em solução aquosa. Esses radicais podem desencadear ou acelerar diversas reações químicas, como polimerização, branqueamento, ataque químico, limpeza e desinfecção. (NH4)2S2O8 também pode atuar como fonte de íons sulfato para a síntese de outros compostos.
P: Em que misturar persulfato de amônio?
R: (NH4)2S2O8 é altamente solúvel em água e pode ser misturado com água para preparar soluções de diferentes concentrações. A solubilidade de (NH4)2S2O8 em água aumenta com o aumento da temperatura. A 25°C pode dissolver até 80g/100ml de água. Também é moderadamente solúvel em metanol. (NH4)2S2O8 não deve ser misturado com substâncias incompatíveis, tais como materiais combustíveis, agentes redutores, metais, ácidos ou bases, pois pode reagir de forma violenta ou explosiva com eles.
P: O peroxidissulfato de amônio é o mesmo que persulfato de amônio?
R: Sim, peroxidissulfato de amônio é outro nome para (NH4)2S2O8. Ambos são sinônimos do mesmo composto com a fórmula (NH4)2S2O8.
P: Para que é usado o persulfato de amônio no SDS-PAGE?
R: SDS-PAGE (eletroforese em gel de poliacrilamida com dodecil sulfato de sódio) é uma técnica para separar proteínas com base em seu tamanho e carga. (NH4)2S2O8 é usado como catalisador para a polimerização de monômeros de acrilamida e bisacrilamida para formar uma matriz de gel de poliacrilamida. (NH4)2S2O8 gera radicais livres que iniciam a reação de reticulação entre os monômeros.
P: Como fazer persulfato de amônio a 10%?
R: Para preparar uma solução de (NH4)2S2O8 a 10%, pesar 10 g de (NH4)2S2O8 sólido e dissolver em 90 ml de água destilada. Agitar até dissolver completamente e transferir para um balão volumétrico de 100 ml. Encha até a marca com água destilada e misture bem. Armazenar a solução num frasco escuro a 4°C ou à temperatura ambiente.
P: Como faço para reparar um persulfato de amônio acionado por arco?
R: Um arco elétrico é um defeito causado por um arco elétrico que danifica a superfície de um metal. Isso pode reduzir a resistência e a resistência à corrosão do metal e causar rachaduras ou falhas. Para reparar um arco elétrico, um método é usar (NH4)2S2O8 como ácido para remover a área afetada. O procedimento é o seguinte:
- Limpe a superfície metálica com acetona ou álcool para remover qualquer sujeira ou graxa.
- Aplique uma fina camada de solução de persulfato de amônio (10-20%) na área atingida pelo arco usando um pincel ou cotonete.
- Aguarde 5 a 10 minutos até que apareçam bolhas na superfície, indicando que está ocorrendo uma reação de oxidação.
- Enxágue a superfície com água e seque com um pano limpo.
- Repita o processo até que o arco seja completamente eliminado.
- Inspecione a superfície em busca de rachaduras ou buracos e preencha-os com material de enchimento apropriado, se necessário.
- Aplique uma camada protetora ou tinta para evitar mais corrosão.
P: O persulfato de amônio é um surfactante?
R: Não, (NH4)2S2O8 não é um surfactante. Um surfactante é uma substância que reduz a tensão superficial de um líquido ou entre dois líquidos, podendo formar micelas ou emulsões. (NH4)2S2O8 não possui essas propriedades. É um agente oxidante que pode liberar radicais de oxigênio em solução aquosa.
P: Quais aspectos do seu experimento são controlados pelo TEMED e pelo persulfato de amônio?
R: TEMED e (NH4)2S2O8 são usados para controlar a polimerização de monômeros de acrilamida e bisacrilamida para formar uma matriz de gel de poliacrilamida para eletroforese. TEMED e (NH4)2S2O8 atuam como catalisadores geradores de radicais livres que iniciam e aceleram a reação de reticulação entre monômeros. A concentração e a proporção de TEMED e (NH4)2S2O8 afetam a taxa e a integridade da polimerização, bem como o tamanho dos poros e a resistência mecânica do gel.
P: O persulfato de amônio reage com o ar?
R: Sim, (NH4)2S2O8 pode reagir com o ar, especialmente em condições úmidas. (NH4)2S2O8 pode absorver a umidade do ar e sofrer hidrólise, formando sulfato de amônio e peróxido de hidrogênio. O peróxido de hidrogênio pode se decompor ainda mais em água e gás oxigênio, liberando calor e pressão. Isto pode causar a ruptura ou explosão do recipiente de (NH4)2S2O8 se não for devidamente ventilado. (NH4)2S2O8 também pode reagir com o oxigênio do ar para formar ozônio, que é um gás tóxico. Portanto, (NH4)2S2O8 deve ser armazenado em local fresco, seco e bem ventilado, longe de calor, faíscas, chamas e outras substâncias incompatíveis.
