O peróxido de sódio (Na2O2) é um poderoso agente oxidante. Ele reage violentamente com a água para liberar oxigênio e pode inflamar materiais combustíveis em contato. É utilizado em diversas reações químicas e como desinfetante.
| Nome IUPAC | óxido de sódio |
| Fórmula molecular | Na2O2 |
| Número CAS | 1313-60-6 |
| Sinônimos | Peróxido de sódio, superóxido de sódio, dióxido dissódico, binóxido de sódio, dióxido de sódio, NaO2, ONU 1507 |
| InChI | InChI=1S/2Na.O2/c;;1-2/q2*+1;-2 |
Propriedades do peróxido de sódio
Fórmula de Peróxido de Sódio
A fórmula química do peróxido de sódio é Na2O2. É um composto iônico composto por dois cátions de sódio (Na+) e um ânion peróxido (O22-). A fórmula do peróxido de sódio é utilizada para representar a composição química do composto e é importante nas reações químicas que envolvem a substância.
Massa molar de peróxido de sódio
O peróxido de sódio, fórmula química Na2O2, tem massa molar de 77,98 g/mol. É um composto iônico composto por dois cátions de sódio (Na+) e um ânion peróxido (O22-). A massa molar do peróxido de sódio é essencial para calcular a quantidade de composto necessária para diversas reações químicas.
Ponto de ebulição do peróxido de sódio
O peróxido de sódio tem um ponto de ebulição muito alto de 657°C (1215°F), tornando-o extremamente estável em altas temperaturas. O composto se decompõe antes de atingir o ponto de ebulição, liberando gás oxigênio e deixando para trás óxido de sódio. O alto ponto de ebulição do peróxido de sódio o torna útil em reações de alta temperatura e processos industriais onde é necessária alta estabilidade térmica.
Ponto de fusão do peróxido de sódio
O peróxido de sódio tem um ponto de fusão de 675°C (1247°F), que é relativamente alto em comparação com outras substâncias comuns. Ele derrete para formar um líquido branco-amarelado e se decompõe acima de seu ponto de fusão para liberar gás oxigênio e formar óxido de sódio. O alto ponto de fusão do peróxido de sódio o torna útil em reações químicas em altas temperaturas.
Densidade do peróxido de sódio g/ml
A densidade do peróxido de sódio é 2,805 g/mL. É um pó branco a amarelado com densidade superior à da água. A alta densidade do peróxido de sódio o torna útil em diversos processos industriais, como branqueamento, desinfecção e produção de outros produtos químicos.
Peso molecular do peróxido de sódio
O peróxido de sódio tem peso molecular de 77,98 g/mol. É um composto iônico com dois cátions de sódio (Na+) e um ânion peróxido (O22-). O peso molecular do peróxido de sódio é importante nas reações químicas que envolvem o composto porque ajuda a determinar as quantidades de reagentes e produtos.
Estrutura do peróxido de sódio
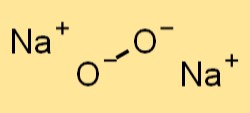
O peróxido de sódio tem uma estrutura cristalina semelhante ao cloreto de sódio (NaCl). Ele forma uma rede cúbica de face centrada, onde os íons sódio ocupam os cantos do cubo e os ânions peróxido estão localizados no centro de cada face. Os ânions peróxidos no peróxido de sódio são mantidos juntos por ligações covalentes, enquanto os íons sódio são mantidos juntos por ligações iônicas.
| Aparência: | Pó branco a amarelado |
| Gravidade Específica: | 2.805g/cm3 |
| Cor: | Branco a amarelado |
| Cheiro: | Inodoro |
| Massa molar: | 77,98 g/mol |
| Densidade: | 2.805g/cm3 |
| Ponto de fusão: | 675°C (1247°F) |
| Ponto de ebulição: | 657°C (1215°F) |
| Ponto de inflamação: | Não aplicável |
| Solubilidade em Água: | Reage violentamente com água |
| Solubilidade: | Solúvel em álcool, éter |
| Pressão de vapor: | Não aplicável |
| Densidade do vapor: | Não aplicável |
| pKa: | Não aplicável |
| PH: | Não aplicável |
Segurança e perigos do peróxido de sódio
| Símbolos de perigo: | Oxidante, Corrosivo |
| Descrição de segurança: | Não inale poeiras/fumos/gases/névoas/vapores. Evite o contato com a pele/olhos. Manuseie e armazene sob gás inerte. Em caso de contato com os olhos, lavar imediatamente com água em abundância e enxaguar com médico. Em caso de incêndio, utilizar meios de extinção apropriados. |
| Números de identificação da ONU: | UN1503 |
| Código SH: | 2829.11.00 |
| Classe de perigo: | 5.1 |
| Grupo de embalagem: | II |
| Toxicidade: | Corrosivo para os olhos e pele, nocivo se ingerido ou inalado. |
Métodos para a síntese de peróxido de sódio
A síntese do peróxido de sódio (Na2O2) é possível através de diversos métodos, como combinação direta, reação com oxigênio e eletrólise.
Um método para sintetizar Na2O2 é o método de combinação direta. Isso envolve o aquecimento do sódio metálico com excesso de oxigênio em uma fornalha. A reação é exotérmica e é fundamental regular a temperatura para evitar superaquecimento e possível explosão.
Outro método envolve a reação do hidróxido de sódio com peróxido de hidrogênio para produzir Na2O2 e água. Este método é mais seguro e controlado do que o método de combinação direta, mas requer uma temperatura mais elevada e um tempo de reação mais longo.
Outro método de síntese de Na2O2 é através da eletrólise. Isto envolve a eletrólise de uma solução de hidróxido de sódio usando um ânodo e um cátodo adequados. Durante a eletrólise, o cátodo produz Na2O2, enquanto o ânodo produz gás oxigênio.
Usos do peróxido de sódio
O peróxido de sódio encontra diversas aplicações industriais e laboratoriais devido às suas propriedades oxidantes e capacidade de liberar oxigênio.
Aqui estão alguns usos comuns do peróxido de sódio:
- Alvejante: Usado como agente de branqueamento para pasta de papel, têxteis e outros materiais.
- Agente Desodorizante: Usado como agente desodorizante em instalações de eliminação de resíduos e tratamento de águas residuais.
- Agente oxidante: usado para oxidar vários compostos orgânicos e inorgânicos.
- Polimerização: Inicia a polimerização de certos monômeros. Utilizado na produção de espuma de poliuretano e outros polímeros.
- Aplicações farmacêuticas: Utilizado como reagente na síntese de compostos farmacêuticos.
- Reagente de Laboratório: Utilizado como reagente de laboratório para diversos fins analíticos e sintéticos.
- Aplicações em células de combustível: Usado como oxidante em células de combustível para gerar energia elétrica.
Questões:
P: Qual é a reação química entre o peróxido de hidrogênio e o bissulfito de sódio?
R: A reação química entre o peróxido de hidrogênio e o bissulfito de sódio produz água e sulfato de sódio. A equação balanceada para a reação é: 2 NaHSO3 + H2O2 → Na2SO4 + 2 H2O.
P: Onde comprar pó de peróxido de sódio?
R: O pó de peróxido de sódio pode ser adquirido de vários fornecedores e distribuidores de produtos químicos. É importante garantir que o fornecedor seja confiável e siga os protocolos de segurança adequados para manuseio e envio de produtos químicos perigosos.
P: O óxido de sódio pode ser transformado em borohidreto e peróxido de hidrogênio?
R: O óxido de sódio não pode ser produzido diretamente a partir do borohidreto e do peróxido de hidrogênio. O óxido de sódio pode ser sintetizado pela reação do sódio metálico com o oxigênio ou pelo aquecimento do hidróxido de sódio. O borohidreto e o peróxido de hidrogênio não são comumente usados na síntese de óxido de sódio.
P: Qual é a fórmula do peróxido de sódio?
R: A fórmula do peróxido de sódio é Na2O2.
P: Qual é o estado de oxidação do Na2O2?
R: O estado de oxidação do sódio em Na2O2 é +1 e o estado de oxidação do oxigênio é -1.
P: Qual é o número de oxidação do oxigênio no composto Na2O2?
R: O número de oxidação do oxigênio no composto Na2O2 é -1.
