O peróxido de potássio (K2O2) é um composto feito de potássio e oxigênio. É frequentemente usado como um forte agente oxidante em indústrias e laboratórios para facilitar diversas reações químicas.
| Nome IUPAC | Peroxioxidanida de potássio |
| Fórmula molecular | K2O2 |
| Número CAS | 17014-71-0 |
| Sinônimos | Superóxido de potássio; Dióxido dipotássico; Dióxido de potássio; Óxido perpotássico |
| InChI | InChI=1S/2K.O2/c;;1-2/q2*+1;-2 |
Propriedades do peróxido de potássio
Fórmula de Peróxido de Potássio
A fórmula química do peróxido de potássio é K2O2. Esta fórmula representa o número e tipo de átomos presentes na molécula. A fórmula é importante para identificar a substância e compreender suas propriedades químicas.
Massa molar de peróxido de potássio
A massa molar do K2O2 é 110,2 g/mol. Isso significa que um mol de K2O2 pesa 110,2 gramas. A massa molar é uma propriedade importante de uma substância porque permite calcular a quantidade de uma substância presente em uma determinada massa ou volume.
Ponto de ebulição do peróxido de potássio
O K2O2 não possui ponto de ebulição específico, pois se decompõe antes de atingir seu ponto de ebulição. Em altas temperaturas, o K2O2 se decompõe em óxido de potássio e gás oxigênio. Portanto, geralmente não é usado em aplicações de alta temperatura.
Ponto de fusão do peróxido de potássio
O ponto de fusão do K2O2 é 655°C. Este alto ponto de fusão o torna um agente oxidante adequado em reações de alta temperatura. No entanto, é importante notar que pode decompor-se antes de atingir o seu ponto de fusão se exposto a altas temperaturas ou humidade.
Densidade do peróxido de potássio g/mL
A densidade do K2O2 é 2,08 g/mL. Essa alta densidade o torna um sólido denso que afunda na água. A densidade do K2O2 também é importante na determinação de sua solubilidade em vários solventes.
Peso molecular do peróxido de potássio
O peso molecular do K2O2 é 110,2 g/mol. Este valor é a soma dos pesos atômicos de todos os átomos presentes na molécula. O peso molecular é uma propriedade importante usada para calcular várias propriedades de uma substância, incluindo sua massa molar e densidade.
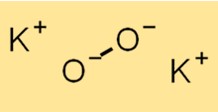
Estrutura do peróxido de potássio
A estrutura do K2O2 é composta por um cátion K+ e um ânion O2^2-. O ânion O2^2- consiste em dois átomos de oxigênio ligados covalentemente. A estrutura do K2O2 é essencial para a compreensão de suas propriedades químicas e reatividade.
| Aparência | Sólido branco a amarelo pálido |
| Gravidade Específica | 2.08 |
| Cor | Branco a amarelo pálido |
| Cheiro | Inodoro |
| Massa molar | 110,2 g/mol |
| Densidade | 2,08g/ml |
| Ponto de fusão | 655°C |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Reage com água |
| Solubilidade | Insolúvel em solventes orgânicos |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Não aplicável |
Segurança e perigos do peróxido de potássio
O K2O2 apresenta vários riscos de segurança devido às suas fortes propriedades oxidantes. Pode reagir vigorosamente com água ou umidade, liberando gás oxigênio e gerando calor. Esta reação pode causar incêndio ou explosão se não for manuseada corretamente. Além disso, pode causar irritação na pele e nos olhos ao entrar em contato, e a inalação de sua poeira pode causar problemas respiratórios. É importante manusear o K2O2 com cuidado, utilizando equipamentos de proteção individual adequados e armazenando-o em local fresco e seco, longe de fontes de calor e materiais incompatíveis. Em caso de exposição acidental, procure imediatamente atendimento médico.
| Símbolos de perigo | Agente oxidante |
| Descrição de segurança | Não exponha à água. Use luvas de proteção e proteção para os olhos/face. Armazenar em local fresco e seco, longe de fontes de calor e materiais incompatíveis. |
| Números de identificação da ONU | ONU1504 |
| Código SH | 2829.90.90 |
| Classe de perigo | 5.1 |
| Grupo de embalagem | II |
| Toxicidade | Pode causar irritação na pele e nos olhos. A inalação de poeira pode causar problemas respiratórios. |
Métodos de síntese de peróxido de potássio
Existem vários métodos para sintetizar K2O2, incluindo a reação do hidróxido de potássio com peróxido de hidrogênio , a reação do hidróxido de potássio com peróxido de bário e a decomposição térmica do superóxido de potássio.
O primeiro método envolve a adição lenta de hidróxido de potássio a uma solução de peróxido de hidrogênio enquanto se agita até formar um precipitado branco de K2O2. O processo envolve filtrar a mistura e lavar o sólido com água fria para remover impurezas.
No segundo método, agite uma suspensão de peróxido de bário enquanto adiciona uma solução de hidróxido de potássio . Filtrar a mistura e evaporar o filtrado até à secura. Em seguida, aqueça o sólido resultante a uma temperatura alta para decompor qualquer peróxido de bário restante e formar K2O2.
O terceiro método envolve o aquecimento do superóxido de potássio a uma alta temperatura, fazendo com que ele se decomponha em K2O2 e gás oxigênio.
Usos do peróxido de potássio
O K2O2 tem diversos usos em diversas indústrias devido às suas propriedades oxidantes. Alguns de seus usos incluem:
- Alvejante: Usado como agente clareador para produtos têxteis e de papel, bem como produtos para clareamento de cabelos e dentes.
- Fonte de Oxigênio: Utilizado como fonte de oxigênio em sistemas fechados, como em submarinos, onde pode liberar oxigênio quando misturado à água.
- Polimerização: Utilizado na polimerização de certos monômeros para produzir polímeros, como na síntese de poliestireno.
- Remediação de solo: Usado para remediação de solo para remover contaminantes orgânicos, como derramamentos de óleo.
- Química Analítica: Usada em química analítica como agente oxidante para determinar a presença de certos compostos.
- Combustível de foguete: Usado como oxidante em combustível de foguete devido à sua capacidade de liberar oxigênio.
- Síntese química: Utilizado na síntese de diversos compostos orgânicos e inorgânicos, como a síntese de permanganato de potássio.
Questões:
P: O que é melhor, peróxido de hidrogênio ou hidróxido de potássio?
R: Depende do uso pretendido. O peróxido de hidrogênio é um poderoso agente oxidante e é comumente usado como desinfetante, alvejante e clareador de cabelos e dentes. Já o hidróxido de potássio é uma base forte e comumente utilizado na produção de sabões e detergentes, bem como na produção de biodiesel a partir de óleos vegetais.
P: Quais são as fórmulas químicas do superóxido de potássio, peróxido de potássio e óxido de potássio?
R: As fórmulas químicas são K2O2 para superóxido de potássio, K2O2 para peróxido de potássio e K2O para óxido de potássio.
P: O que é formado quando o peróxido de hidrogênio reage com iodeto de potássio e iodato?
R: Quando o peróxido de hidrogênio reage com iodeto e iodato de potássio, o iodo é produzido de acordo com a seguinte reação: H2O2 + KI + KIO3 → I2 + K2O + H2O.
P: Qual é o número de oxidação do átomo de oxigênio no K2O2?
R: O número de oxidação do átomo de oxigênio em K2O2 é -1.
P: Qual é o número de oxidação de K em K2O2?
R: O número de oxidação de K em K2O2 é +1.
