O peróxido de hidrogênio ou H2O2 é um líquido azul claro com fortes propriedades oxidantes. É comumente usado como desinfetante, alvejante e em foguetes como propelente. Em altas concentrações pode ser prejudicial.
| Nome IUPAC | Dióxido de dihidrogênio |
| Fórmula molecular | H2O2 |
| Número CAS | 7722-84-1 |
| Sinônimos | Dióxido de Hidrogênio, Peróxido, Oxydol, Superoxol, Dióxido de Hidrônio, Peroxaan, Asepticper, etc. |
| InChI | InChI=1S/H2O2/c1-2/h1-2H |
Propriedades do peróxido de hidrogênio
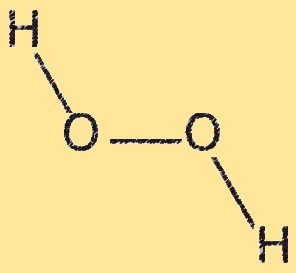
Estrutura H2O2
O peróxido de hidrogênio possui estrutura molecular curva, com um ângulo de aproximadamente 104,5 graus entre os dois átomos de oxigênio. A molécula tem duas ligações OH e uma ligação OO. A ligação OO é fraca e facilmente quebrada, tornando o peróxido de hidrogênio um forte agente oxidante. A estrutura curva do peróxido de hidrogênio resulta da repulsão entre pares solitários de elétrons nos átomos de oxigênio.
Fórmula de peróxido de hidrogênio
A fórmula química do peróxido de hidrogênio é H2O2, o que indica que cada molécula de peróxido de hidrogênio contém dois átomos de hidrogênio e dois átomos de oxigênio. A fórmula é uma forma concisa de representar a composição molecular de uma substância. A fórmula química do peróxido de hidrogênio é importante para a compreensão de suas propriedades e de suas reações com outras substâncias.
Massa molar de peróxido de hidrogênio
O peróxido de hidrogênio tem massa molar de aproximadamente 34,01 g/mol. A massa molar é a soma das massas atômicas de todos os átomos de uma molécula do composto. O peróxido de hidrogênio tem dois átomos de hidrogênio e dois átomos de oxigênio em cada molécula, portanto sua massa molar é calculada somando a massa atômica de cada átomo. A massa molar é uma propriedade importante de uma substância porque é usada em cálculos estequiométricos para determinar a quantidade de substância presente em uma determinada amostra.
Ponto de ebulição do peróxido de hidrogênio
O ponto de ebulição do peróxido de hidrogênio é 150,2°C (302,4°F). Esta temperatura é o ponto em que a pressão de vapor do líquido se iguala à pressão atmosférica. Acima dessa temperatura, o líquido se transforma em gás e, abaixo dessa temperatura, permanece no estado líquido. O ponto de ebulição do peróxido de hidrogênio é superior ao da água, que ferve a 100°C, devido à presença de ligações de hidrogênio intermoleculares no peróxido de hidrogênio.
Ponto de fusão do peróxido de hidrogênio
O ponto de fusão do peróxido de hidrogênio é -0,43°C (31,23°F). Esta temperatura é o ponto em que os estados sólido e líquido de uma substância estão em equilíbrio. A esta temperatura, a forma sólida do peróxido de hidrogênio derrete em líquido. O ponto de fusão do peróxido de hidrogênio é inferior ao da água, que derrete a 0°C, devido à natureza instável da molécula de peróxido de hidrogênio.
Densidade do peróxido de hidrogênio g/mL
A densidade do peróxido de hidrogênio é 1,11 g/mL em temperatura e pressão padrão (STP). Isso significa que um mililitro de peróxido de hidrogênio pesa 1,11 gramas. A densidade do peróxido de hidrogênio é maior que a da água, que tem densidade de 1 g/mL, devido à presença de átomos de oxigênio mais pesados no peróxido de hidrogênio.
Peso molecular do peróxido de hidrogênio
O peso molecular do peróxido de hidrogênio é 34,01 g/mol. Este valor é calculado adicionando as massas atômicas de cada átomo em uma molécula de peróxido de hidrogênio. O peso molecular é uma propriedade importante de uma substância porque é usado em vários cálculos, inclusive na determinação da concentração de peróxido de hidrogênio em uma solução.
| Aparência | Líquido límpido e incolor |
| Gravidade Específica | 1,11 g/cm3 a 20°C |
| Cor | Azul pálido (forma pura) |
| Cheiro | Quase inodoro (forma pura) |
| Massa molar | 34,01 g/mol |
| Densidade | 1,11 g/mL a 20°C |
| Ponto de fusão | -0,43ºC |
| Ponto de ebulição | 150,2ºC |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Completamente miscível com água |
| Solubilidade | Solúvel em álcool, éter e outros solventes orgânicos |
| Pressão de vapor | 23,3 mmHg a 20°C |
| Densidade do vapor | 1,1 (ar = 1) |
| pKa | 11,6 (a 25°C) |
| pH | 4,5 – 6,0 (solução a 10%) |
Nota: Estes valores são valores típicos e podem variar dependendo da pureza, concentração e outros fatores.
Segurança e perigos do peróxido de hidrogênio
O peróxido de hidrogênio pode ser perigoso se manuseado incorretamente. É um forte agente oxidante que pode reagir violentamente com substâncias orgânicas e inorgânicas, podendo causar incêndio ou explosão. A forma concentrada de peróxido de hidrogênio também é corrosiva e pode causar queimaduras graves ou danos aos tecidos se entrar em contato com a pele ou os olhos. A inalação de vapores de peróxido de hidrogênio pode irritar o trato respiratório e sua ingestão pode causar sérios danos internos ou morte. Portanto, precauções de segurança adequadas, como usar roupas e luvas de proteção, evitar contato com substâncias incompatíveis e usar em área bem ventilada, devem ser tomadas ao manusear o peróxido de hidrogênio.
| Símbolos de perigo | Ó,C |
| Descrição de segurança | Manter afastado do calor, faíscas e chamas. Use roupas e luvas de proteção. Evite contato com a pele, olhos e roupas. Não respire os vapores. Em caso de incêndio, utilizar água pulverizada, espuma, pó químico seco ou dióxido de carbono. |
| Números de identificação da ONU | ONU2015 |
| Código SH | 2847.00.00 |
| Classe de perigo | 5.1 |
| Grupo de embalagem | II |
| Toxicidade | Tóxico se ingerido ou inalado. Causa queimaduras na pele e lesões oculares graves. Pode causar irritação respiratória. Pode causar incêndio ou explosão. |
Métodos de síntese de peróxido de hidrogênio
O peróxido de hidrogênio pode ser sintetizado por vários métodos, incluindo o processo de antraquinona, autooxidação de 2-etilantrahidroquinona e eletrólise de ácido sulfúrico diluído. O método mais comum para produção comercial de peróxido de hidrogênio é o processo de antraquinona.
No processo da antraquinona, a antraquinona é primeiro hidrogenada para formar antrahidroquinona, que é então oxidada com ar na presença de um catalisador para produzir peróxido de hidrogênio. O peróxido de hidrogênio é então extraído e purificado por meio de diversas técnicas, como destilação e filtração.
Outro método de síntese de peróxido de hidrogênio é a autooxidação da 2-etilantrahidroquinona. Neste método, a 2-etilantrahidroquinona é exposta ao ar na presença de um catalisador alcalino, que promove a autooxidação do composto para produzir peróxido de hidrogênio.
A eletrólise do ácido sulfúrico diluído é outro método de síntese do peróxido de hidrogênio. Neste método, o ácido sulfúrico diluído é eletrolisado por meio de uma célula eletrolítica especial, que gera peróxido de hidrogênio em um dos eletrodos.
O peróxido de hidrogênio também pode ser sintetizado por outros métodos, como síntese direta a partir de hidrogênio e oxigênio ou redução de peróxidos com agentes redutores. No entanto, estes métodos não são comumente utilizados para a produção comercial de peróxido de hidrogênio devido à sua baixa eficiência e preocupações de segurança.
Usos do peróxido de hidrogênio
O peróxido de hidrogênio é um composto químico versátil com uma ampla gama de aplicações em diversos setores. Aqui estão alguns usos comuns do peróxido de hidrogênio:
- As indústrias têxtil, de papel e celulose comumente utilizam H2O2 como agente branqueador para remover a cor de tecidos e celulose.
- As instalações de saúde utilizam H2O2 como um desinfetante eficaz para matar bactérias, vírus e fungos e para esterilizar equipamentos e superfícies médicas.
- As estações de tratamento de água utilizam H2O2 para remover impurezas como ferro e manganês e para desinfetar a água.
- As tinturas de cabelo e os produtos de clareamento dental usam H2O2 para clarear a cor dos cabelos e dos dentes.
- A indústria aeroespacial usa H2O2 como propulsor de foguetes.
- A produção de diversos polímeros, como polipropileno, polietileno e poliestireno, envolve a utilização de H2O2.
- H2O2 é um agente de limpeza útil para remover manchas e sujeira de superfícies e limpar lentes de contato.
- O H2O2 é utilizado na indústria alimentícia como agente branqueador e conservante de produtos alimentícios.
No geral, a versatilidade do H2O2 o torna um composto químico valioso com muitas aplicações em diversos setores.
Questões:
Preço do peróxido de hidrogênio
O preço do peróxido de hidrogênio pode variar amplamente dependendo de vários fatores, como pureza, concentração e quantidade adquirida. Em geral, o preço do peróxido de hidrogênio pode variar de centavos por libra para peróxido de hidrogênio de grau técnico a vários dólares por libra para graus de alta pureza usados em aplicações especiais.
Em fevereiro de 2023, o preço médio do peróxido de hidrogênio de qualidade alimentar a 35% era de aproximadamente US$ 20 a US$ 30 por galão ou US$ 0,10 a US$ 0,20 por onça fluida. O peróxido de hidrogênio de nível industrial com menor pureza e concentração pode custar menos, geralmente entre US$ 1 e US$ 5 por galão. No entanto, os preços podem variar dependendo do fornecedor, região e outros fatores.
Onde comprar peróxido de hidrogênio?
O peróxido de hidrogênio é um composto químico comum que pode ser adquirido em vários fornecedores, tanto online quanto em lojas físicas. Aqui estão alguns lugares onde você pode comprar peróxido de hidrogênio:
- Fornecedores de produtos químicos: Fornecedores de produtos químicos, como Sigma-Aldrich, Fisher Scientific e VWR International, oferecem uma ampla variedade de graus e concentrações de peróxido de hidrogênio para diversas aplicações.
- Mercados online: Os mercados online, como Amazon, eBay e Alibaba, oferecem peróxido de hidrogênio de vários fornecedores, com diferentes qualidades e concentrações.
- Mercearias e farmácias: Muitas mercearias e farmácias vendem peróxido de hidrogênio de baixa concentração (3% a 6%) como anti-séptico para limpeza de feridas e primeiros socorros.
- Lojas de materiais para piscinas: O peróxido de hidrogênio pode ser usado como oxidante de piscinas e spas para manter a clareza e a desinfecção da água. Lojas de materiais para piscinas, como a Leslie’s Pool Supplies, podem vender produtos de peróxido de hidrogênio para essa finalidade.
