O perclorato de sódio é um composto químico com a fórmula NaClO4. É um sólido cristalino branco altamente solúvel em água e comumente utilizado como agente oxidante em diversos processos industriais.
| Nome IUPAC | Perclorato de sódio |
| Fórmula molecular | NaClO4 |
| Número CAS | 7601-89-0 |
| Sinônimos | Ácido perclórico, sal de sódio; Perclorato de sódio (francês); Perclorato de sódio (alemão); Perclorato de sódio (italiano); Perclorato sódico (espanhol); ONU 1502 |
| InChI | InChI=1S/ClHO4.Na/c2-1(3,4)5;/h(H,2,3,4,5);/q;+1/p-1 |
Propriedades do perclorato de sódio
Fórmula de perclorato de sódio
A fórmula química do perclorato de sódio é NaClO4. Isso significa que o composto é composto por um átomo de sódio, um átomo de cloro e quatro átomos de oxigênio. O perclorato de sódio é um poderoso agente oxidante comumente usado em vários processos industriais.
Massa molar de perclorato de sódio
A massa molar do NaClO4 é 122,44 g/mol. Isto significa que um mol de NaClO4 contém 122,44 gramas do composto. A massa molar de um composto é importante para determinar a quantidade de substância necessária para uma reação química.
Ponto de ebulição do perclorato de sódio
O ponto de ebulição do NaClO4 é 545°C (1013 hPa). Esta é a temperatura na qual o composto muda de líquido para gasoso. O NaClO4 tem um alto ponto de ebulição devido às fortes forças eletrostáticas entre os íons sódio e perclorato.
Ponto de fusão do perclorato de sódio
O ponto de fusão do NaClO4 é 482°C. Esta é a temperatura na qual o composto muda do estado sólido para o estado líquido. O NaClO4 tem um alto ponto de fusão devido às fortes forças eletrostáticas entre os íons sódio e perclorato.
Densidade de perclorato de sódio g/mL
A densidade do NaClO4 é 2,52 g/mL. Isto significa que um mililitro de NaClO4 pesa 2,52 gramas. A densidade de uma substância é importante na determinação de suas propriedades físicas, como flutuabilidade e viscosidade.
Peso molecular do perclorato de sódio
O peso molecular do NaClO4 é 122,44 g/mol. Esta é a soma dos pesos atômicos dos átomos de sódio, cloro e oxigênio no composto. O peso molecular de um composto é importante na determinação de suas propriedades físicas e químicas.
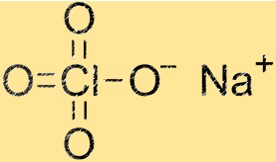
Estrutura do perclorato de sódio
A estrutura do NaClO4 é uma rede cristalina composta por cátions Na+ e ânions ClO4-. Os cátions de sódio são cercados por quatro átomos de oxigênio, enquanto os ânions ClO4- consistem em um átomo de cloro e quatro átomos de oxigênio. A estrutura cristalina confere ao NaClO4 suas propriedades físicas e químicas características.
Solubilidade do perclorato de sódio
O NaClO4 é altamente solúvel em água, com solubilidade de 209 g/100 mL a 20°C. Isto significa que uma grande quantidade de NaClO4 pode dissolver-se numa pequena quantidade de água. A alta solubilidade do NaClO4 o torna útil em diversos processos industriais, como a produção de perclorato de amônio para combustível de foguetes.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 2,52g/ml |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 122,44 g/mol |
| Densidade | 2,52g/ml |
| Ponto de fusão | 482°C |
| Ponto de ebulição | 545°C (1013hPa) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 209 g/100 mL a 20°C |
| Solubilidade | Solúvel em água e etanol |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | Não disponível |
| pH | Não disponível |
Segurança e perigos do perclorato de sódio
O NaClO4 é um composto perigoso que deve ser manuseado com cuidado. É um forte agente oxidante que pode reagir violentamente com materiais orgânicos, agentes redutores e outros produtos químicos. A exposição ao pó ou vapor de NaClO4 pode causar irritação nos olhos, pele e sistema respiratório. A ingestão de NaClO4 pode causar irritação gastrointestinal, náuseas e vómitos. O NaClO4 também é prejudicial à vida aquática e deve ser descartado de maneira adequada. Equipamentos de proteção individual, como luvas, óculos de proteção e respirador, devem ser usados ao manusear NaClO4 para evitar exposição. Ventilação e armazenamento adequados também são importantes para minimizar o risco de acidentes.
| Símbolos de perigo | Ó, Xn |
| Descrição de segurança | Não respirar poeiras/fumos/gases/névoas/vapores/aerossóis. Use luvas de proteção/roupas de proteção/proteção ocular/proteção facial. EM CASO DE INALAÇÃO: Remover a vítima para um local ao ar livre e mantê-la em repouso numa posição confortável para respirar. EM CASO DE INGESTÃO: Enxágue a boca. NÃO induza o vômito. Ligue para um CENTRO DE INFORMAÇÃO ANTIVENENOS ou um médico se não se sentir bem. |
| Números de identificação da ONU | UN1502 |
| Código SH | 2829.90.90 |
| Classe de perigo | 5.1 |
| Grupo de embalagem | II |
| Toxicidade | Tóxico se ingerido, nocivo se inalado ou em contato com a pele. Pode causar irritação ou corrosão. |
Métodos para a síntese de perclorato de sódio
Vários métodos podem sintetizar NaClO4.
Um método comum envolve a reação do clorato de sódio com ácido clorídrico , resultando na formação de NaClO4 e cloreto de sódio .
Outro método envolve a eletrólise de uma solução de cloreto de sódio na presença de um sal perclorato. Ocorre a conversão do cloreto de sódio em clorato de sódio, seguida da adição de ácido clorídrico, que o converte em NaClO4.
Outra abordagem é reagir o clorato de sódio com cloreto de sódio na presença de ácido sulfúrico. Este método produz uma mistura de NaClO4 e sulfato de sódio, que pode ser separada por cristalização fracionada.
Outro método envolve a reação do clorato de sódio com perclorato de amônio, que produz NaClO4 e cloreto de amônio. A produção de NaClO4, comumente usado como oxidante em propulsores sólidos de foguetes, envolve o uso deste método.
A reação do hipoclorito de sódio com clorato de sódio na presença de ácido clorídrico também sintetiza NaClO4. Este método produz NaClO4 e cloreto de sódio como principais produtos.
Usos do perclorato de sódio
O NaClO4 tem vários usos em diferentes indústrias. Aqui estão algumas aplicações comuns de NaClO4:
- Propulsores de Foguete: Comumente usados como oxidantes em propelentes de foguetes sólidos devido ao seu alto teor de oxigênio e alta estabilidade.
- Pirotecnia: Utilizado como oxidante em composições pirotécnicas como sinalizadores, fogos de artifício e sinalizadores.
- Química Analítica: Utilizada como fonte de íons perclorato em química analítica para a determinação de íons em diversas amostras.
- Galvanoplastia: Utilizado como componente em soluções de galvanoplastia para melhorar a condutividade e estabilidade do banho de galvanização.
- Baterias: Utilizado como eletrólito em baterias de íon-lítio, devido à sua alta solubilidade e capacidade de melhorar as propriedades eletroquímicas da bateria.
- Aplicações Médicas: Utilizado no tratamento de distúrbios da tireoide como inibidor competitivo do transporte de iodo. Também utilizado na produção de agentes de contraste para imagens médicas.
- Tratamento de Água: Utilizado no tratamento de água como desinfetante e para remover certos contaminantes da água.
Questões:
P: Qual é a fórmula do perclorato de sódio?
R: NaClO4.
P: O perclorato de sódio é solúvel em água?
R: Sim, o NaClO4 é altamente solúvel em água.
P: O perclorato de sódio é um ácido ou uma base?
R: NaClO4 não é ácido nem base. É sal.
P: Qual é a reação do perclorato de amônio e do brometo de sódio?
R: A reação é: NH4ClO4 + NaBr → NaClO4 + NH4Br.
P: Quantos íons de sódio existem no perclorato de sódio?
R: Existe um íon sódio no NaClO4.
P: O NaClO4 é um ácido ou uma base?
R: NaClO4 não é ácido nem base. É um sal.
P: Quais espécies dissolvidas estão presentes em uma solução de NaClO4?
R: Em uma solução de NaClO4, as espécies dissolvidas são os íons Na+ e ClO4-.
P: Quantos mols de oxigênio existem em 3,30 mols de NaClO4?
R: Existem 13,2 moles de oxigênio em 3,30 moles de NaClO4.
P: O NaClO4 é solúvel em água?
R: Sim, o NaClO4 é altamente solúvel em água.
P: Quantos moles de oxigênio existem em 1,10 moles de NaClO4?
R: Existem 4,4 moles de oxigênio em 1,10 moles de NaClO4.
