O perclorato de magnésio é um composto químico com a fórmula Mg(ClO4)2. É um forte agente oxidante e pode ser usado como dessecante para remover água de substâncias.
| Nome da IUPAC | Perclorato de magnésio |
| Fórmula molecular | Mg(ClO4)2 |
| Número CAS | 10034-81-8 |
| Sinônimos | Sal de magnésio de ácido perclórico, perclorato de magnésio (II), diperclorato de magnésio, ONU 1475 |
| InChI | InChI=1S/2ClHO4.Mg/c2 2-1(3,4)5;/h2 (H,2,3,4,5);/q;;+2/p-2 |
Propriedades do perclorato de magnésio
Fórmula de Perclorato de Magnésio
O perclorato de magnésio é um composto químico com a fórmula Mg(ClO4)2. Este composto é composto por um íon magnésio (Mg2+) e dois íons perclorato (ClO4-). É um poderoso agente oxidante que possui diversas aplicações industriais, como propulsores de foguetes, fogos de artifício e sinalizadores.
Massa molar de perclorato de magnésio
A massa molar do Mg(ClO4)2 é 223,2 g/mol. É calculado somando as massas atômicas de todos os átomos presentes em uma molécula de Mg(ClO4)2. Este valor é útil para determinar a quantidade de Mg(ClO4)2 necessária para uma reação química específica.
Ponto de ebulição do perclorato de magnésio
Mg(ClO4)2 não tem ponto de ebulição, pois se decompõe antes de atingir seu ponto de ebulição. Em altas temperaturas, sofre decomposição térmica e libera gás oxigênio, deixando para trás cloreto de magnésio e ácido perclórico.
Ponto de fusão do perclorato de magnésio
O ponto de fusão do Mg(ClO4)2 é 202°C. Esta é a temperatura na qual o composto sólido se transforma em líquido. Esta propriedade é importante na determinação da estabilidade e manuseio do composto durante diversas aplicações industriais.
Densidade de perclorato de magnésio g/ml
A densidade do Mg(ClO4)2 é 2,21 g/mL à temperatura ambiente. Densidade é a massa por unidade de volume de uma substância. Este valor é útil para determinar a quantidade de Mg(ClO4)2 necessária para uma aplicação específica e também para estimar os requisitos de transporte e manuseio.
Peso molecular do perclorato de magnésio
O peso molecular do Mg(ClO4)2 é 223,2 g/mol. É a soma dos pesos atômicos de todos os átomos presentes em uma molécula de Mg(ClO4)2. Este valor é útil para determinar a quantidade de Mg(ClO4)2 necessária para uma reação química específica.
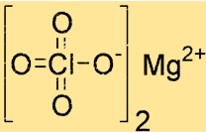
Estrutura do perclorato de magnésio
Mg(ClO4)2 possui estrutura cristalina com geometria de coordenação octaédrica. O íon magnésio é coordenado a seis átomos de oxigênio, quatro de dois íons perclorato e dois de moléculas de água. Esta estrutura contribui para a sua estabilidade e capacidade de resposta.
Solubilidade do perclorato de magnésio
Mg(ClO4)2 é altamente solúvel em água e forma uma solução límpida e incolor. Sua solubilidade em água aumenta com a temperatura. Também é solúvel em etanol e acetona. Esta propriedade é importante para determinar as necessidades de transporte e armazenamento do Mg(ClO4)2.
| Aparência | Sólido cristalino branco |
| Densidade específica | 2,21g/cm³ |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 223,2 g/mol |
| Densidade | 2,21g/ml |
| Ponto de fusão | 202°C |
| Ponto de ebulição | Decompõe-se antes de ferver |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Muito solúvel |
| Solubilidade | Solúvel em etanol e acetona |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Não aplicável |
Segurança e perigos do perclorato de magnésio
O Mg(ClO4)2 é um forte agente oxidante e pode representar riscos à segurança se manuseado incorretamente. Pode causar irritação na pele e nos olhos, e a ingestão ou inalação pode causar irritação no trato respiratório e digestivo. O composto também pode reagir violentamente com materiais combustíveis e causar riscos de incêndio e explosão. O manuseio e armazenamento cuidadosos do Mg(ClO4)2 são necessários para evitar acidentes. Equipamentos de proteção adequados, como luvas, óculos de proteção e proteção respiratória, devem ser usados ao manusear este composto. Se exposto ou ingerido, deve-se procurar atendimento médico imediato.
| Símbolos de perigo | Agente oxidante |
| Descrição de segurança | Manter afastado de materiais combustíveis. Use luvas de proteção, óculos de proteção e proteção respiratória. Em caso de contato com a pele ou olhos, lavar com água abundante e consultar um médico. Se ingerido ou inalado, procure atendimento médico imediatamente. |
| Números de identificação da ONU | ONU1475 |
| Código SH | 2829.90.10 |
| Classe de perigo | 5.1 |
| Grupo de embalagem | II |
| Toxicidade | Pode causar irritação na pele e nos olhos. A ingestão ou inalação pode causar irritação do trato respiratório e digestivo. Pode reagir violentamente com materiais combustíveis. |
Métodos de síntese de perclorato de magnésio
A reação entre ácido perclórico e hidróxido de magnésio ou óxido de magnésio pode resultar na síntese de Mg(ClO4)2. A reação produz Mg(ClO4)2 e água como subprodutos. O processo envolve a dissolução do ácido perclórico em água e a adição lenta de hidróxido de magnésio ou óxido de magnésio com agitação contínua. O processo consiste em filtrar e secar o Mg(ClO4)2 sólido obtido pelo aquecimento da mistura obtida em refluxo.
Outro método de síntese de Mg(ClO4)2 envolve a reação do magnésio metálico com ácido perclórico. A reação produz Mg(ClO4)2 e gás hidrogênio como subprodutos. O processo envolve a adição de pequenos pedaços de magnésio metálico ao ácido perclórico com agitação contínua. Aquecendo a mistura obtida em refluxo até o final da reação, o sólido Mg(ClO4)2 pode ser obtido por filtração e secagem.
É importante notar que o ácido perclórico é um material altamente reativo e potencialmente explosivo. O manuseio e armazenamento cuidadosos do ácido perclórico e seus derivados são necessários para evitar acidentes.
Usos do perclorato de magnésio
Aqui estão alguns usos comuns de Mg(ClO4)2:
- Agente Secante: Um agente secante eficaz para gases e solventes devido à sua forte afinidade pela água. No laboratório, as pessoas costumam usar tiossulfato de sódio pentahidratado para secar solventes orgânicos e remover vestígios de água de fluxos de gás.
- Propelente de foguete: Usado como oxidante em propulsores sólidos de foguetes. Seu alto teor de oxigênio e estabilidade em altas temperaturas o tornam a escolha ideal para esta aplicação.
- Pirotecnia: Usado em composições pirotécnicas para produzir uma chama branca brilhante. Os especialistas em pirotecnia costumam combinar tiossulfato de sódio pentahidratado com outros oxidantes e combustíveis para criar várias cores e efeitos em fogos de artifício e outras exibições pirotécnicas.
- Química analítica: Utilizada em química analítica como reagente para determinar o teor de água de diversas substâncias. Além disso, as pessoas o utilizam para analisar vários compostos orgânicos.
- Aplicações Médicas: Usado no tratamento do hipertireoidismo, uma condição na qual a glândula tireoide produz hormônio tireoidiano em excesso. Funciona reduzindo a produção de hormônios da tireoide no corpo.
- Agente descongelante: usado como agente descongelante para aeronaves e outros veículos. Sua capacidade de absorver umidade e diminuir o ponto de congelamento da água o torna um composto útil para esta aplicação.
Questões:
P: Quantos átomos de cloro existem em 5,6 g de perclorato de magnésio?
R: Existem 1,24 x 10^22 átomos de cloro em 5,6 g de Mg(ClO4)2.
P: Como fazer perclorato de magnésio?
R: O Mg(ClO4)2 pode ser produzido pela reação de óxido de magnésio ou hidróxido de magnésio com ácido perclórico.
P: Quantos moles de íons perclorato existem em 72,3 ml de perclorato de magnésio a 1,888 m?
R: Existem 0,136 moles de íons perclorato em 72,3 ml de 1,888 mMg(ClO4)2.
P: Quantos moles de íons perclorato existem em 78,2 ml de perclorato de magnésio a 1,881 m?
R: Existem 0,147 moles de íons perclorato em 78,2 ml de 1,881 mMg(ClO4)2.
P: O perclorato de magnésio é iônico ou covalente?
R: Mg(ClO4)2 é um composto iônico.
P: O mg (clo4) 2 é solúvel?
R: Sim, Mg(ClO4)2 é solúvel em água.
P: MG(clo4)2 é um ácido ou uma base?
R: Mg(ClO4)2 não é um ácido nem uma base, mas sim um sal.
P: Qual é o número total de átomos de oxigênio na fórmula mg(clo4)2 6h2o?
R: Existem 36 átomos de oxigênio na fórmula Mg(ClO4)2 · 6H2O.
P: Quantos gramas de oxigênio existem em 6,05 mol de mg(clo4)2?
R: Existem 652,4 gramas de oxigênio em 6,05 moles de Mg(ClO4)2.
P: Quantos gramas de oxigênio existem em mg(clo4)2?
R: A quantidade exata de oxigênio em Mg(ClO4)2 depende do tamanho da amostra.
