O perclorato de cálcio (Ca(ClO4)2) é um composto químico que tem muitos usos, inclusive em fogos de artifício e propulsores de foguetes. É muito solúvel em água e também pode ser usado como agente secante.
| Nome IUPAC | Perclorato de cálcio |
| Fórmula molecular | Ca(ClO4)2 |
| Número CAS | 13477-36-6 |
| Sinônimos | Calciofos, sal de cálcio de ácido perclórico, diperclorato de cálcio, perclorato de cálcio (II), UN1459 |
| InChI | InChI=1S/Ca.2ClHO4/c;2 2-1(3,4)5/h;2 (H,2,3,4,5)/q+2;;/p-2 |
Propriedades do perclorato de cálcio
Fórmula de perclorato de cálcio
A fórmula do perclorato de cálcio é Ca(ClO4)2. É composto por um íon Ca2+ e dois íons ClO4-. O íon cálcio tem carga positiva de 2+ e cada íon ClO4- tem carga negativa de 1-. Esta fórmula é usada para representar a estrutura química do perclorato de cálcio.
Massa molar de perclorato de cálcio
A massa molar do Ca(ClO4)2 é 238,98 g/mol. Este valor representa a massa de um mol de Ca(ClO4)2, que contém o número de moléculas de Avogadro. A massa molar é importante na determinação da quantidade de Ca(ClO4)2 necessária em uma reação específica.
Ponto de ebulição do perclorato de cálcio
Ca(ClO4)2 não tem ponto de ebulição porque se decompõe antes de atingir seu ponto de ebulição. Quando aquecido, decompõe-se em cloreto de cálcio, gás oxigênio e gás cloro. Esta reação de decomposição é fortemente exotérmica, liberando uma quantidade significativa de calor.
Ponto de fusão do perclorato de cálcio
O ponto de fusão do Ca(ClO4)2 é 200°C. Esta temperatura é o ponto em que o Ca(ClO4)2 sólido se transforma em estado líquido. O ponto de fusão é importante na determinação das propriedades físicas do Ca(ClO4)2, como sua capacidade de ser usado como agente secante.
Densidade de perclorato de cálcio g/mL
A densidade do Ca(ClO4)2 é 2,505 g/mL. Este valor representa a quantidade de massa por unidade de volume de Ca(ClO4)2. A densidade do Ca(ClO4)2 é maior que a da água, o que significa que ele afunda na água.
Peso molecular do perclorato de cálcio
O peso molecular do Ca(ClO4)2 é 238,98 g/mol. Este valor representa a soma dos pesos atômicos de todos os átomos de uma molécula de Ca(ClO4)2. O peso molecular é importante na determinação da quantidade de Ca(ClO4)2 necessária em uma reação específica.
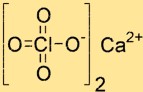
Estrutura do perclorato de cálcio
A estrutura do Ca(ClO4)2 é composta por um íon Ca2+ e dois íons ClO4-. O íon Ca2+ está localizado no centro da estrutura e é circundado por quatro átomos de oxigênio originados de dois íons ClO4-. Os íons ClO4- têm formato tetraédrico e estão conectados ao íon cálcio por átomos de oxigênio.
Solubilidade do perclorato de cálcio
Ca(ClO4)2 é altamente solúvel em água, com solubilidade de 121 g/100 mL a 20°C. Essa solubilidade o torna útil como agente secante porque pode absorver água do ambiente. No entanto, é insolúvel em solventes orgânicos como etanol e acetona.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 2.505g/ml |
| Cor | Branco |
| Cheiro | Inodoro |
| Massa molar | 238,98 g/mol |
| Densidade | 2.505g/ml |
| Ponto de fusão | 200ºC |
| Ponto de ebulição | Decompõe-se antes do ponto de ebulição |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 121 g/100 mL a 20°C |
| Solubilidade | Insolúvel em solventes orgânicos |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | Não disponível |
| pH | Não aplicável |
Segurança e perigos do perclorato de cálcio
O Ca(ClO4)2 apresenta vários riscos de segurança e devem ser tomadas medidas de segurança adequadas ao manuseá-lo. É um oxidante forte que pode reagir com materiais inflamáveis, causando incêndio ou explosão. A inalação de poeira ou vapor pode causar irritação do trato respiratório e o contato com a pele pode causar irritação ou queimaduras. Também é prejudicial se ingerido, causando irritação ou corrosão do trato digestivo. Equipamentos de proteção individual adequados, como luvas e óculos de proteção, devem ser usados ao manusear Ca(ClO4)2 e devem ser armazenados longe de materiais inflamáveis e substâncias incompatíveis.
| Símbolos de perigo | Agente oxidante, prejudicial se ingerido |
| Descrição de segurança | Manter afastado de materiais inflamáveis e substâncias incompatíveis. Use luvas e óculos de proteção. Evite a inalação de poeira ou vapores. Em caso de contato, lavar com água em abundância e consultar um médico se necessário. |
| Números de identificação da ONU | UN1502 |
| Código SH | 2829.9000 |
| Classe de perigo | 5.1 – Substâncias oxidantes |
| Grupo de embalagem | II |
| Toxicidade | Nocivo se ingerido, irritante para a pele e sistema respiratório |
Métodos para a síntese de perclorato de cálcio
Ca(ClO4)2 pode ser sintetizado pela reação de hidróxido de cálcio com ácido perclórico ou perclorato de amônio.
Um método envolve a reação de carbonato de cálcio com ácido perclórico em um recipiente de reação, seguido de filtração e evaporação da solução para obter o produto sólido.
Outro método envolve a reação do óxido de cálcio com uma solução aquosa de ácido perclórico, seguida de filtração e secagem do produto resultante.
Em alguns casos, o Ca(ClO4)2 pode ser sintetizado pela reação do cloreto de cálcio com perclorato de sódio em um recipiente de reação. O produto pode ser filtrado e seco para obter Ca(ClO4)2 após a reação.
Outro método popular para sintetizar Ca(ClO4)2 envolve a reação do cloreto de cálcio com perclorato de amônio, que produz Ca(ClO4)2 e cloreto de amônio como subprodutos. As aplicações pirotécnicas preferem este método devido à sua capacidade de produzir Ca(ClO4)2 de alta pureza.
É importante ressaltar que ao trabalhar com ácido perclórico devem ser tomados os devidos cuidados de segurança, pois é um forte agente oxidante que pode reagir com materiais orgânicos, causando incêndio ou explosão.
Usos do perclorato de cálcio
Ca(ClO4)2 tem diversos usos em diversas indústrias e aplicações. Alguns dos usos do Ca(ClO4)2 são:
- Pirotecnia: Comumente utilizado em pirotecnia como agente oxidante devido ao seu alto teor de oxigênio e estabilidade.
- Fertilizante: Utilizado em fertilizantes para fornecer às plantas cálcio e cloro, nutrientes essenciais para o seu crescimento.
- Combustível de foguete: Usado como componente de combustível de foguete devido ao seu alto teor de oxigênio e estabilidade.
- Refino de petróleo: Usado na indústria do petróleo para remover compostos de enxofre do petróleo bruto e outros hidrocarbonetos.
- Infladores de airbag: Utilizados na fabricação de infladores de airbag devido à sua capacidade de quebrar rapidamente e gerar gases.
- Flares: Utilizados na fabricação de flares devido ao seu alto teor de oxigênio e estabilidade.
- Tratamento de superfícies metálicas: Utilizado no tratamento de superfícies metálicas para remover ferrugem e outras impurezas.
- Aplicações Laboratoriais: Utilizado em diversas aplicações laboratoriais, como na preparação de ácido perclórico e como agente secante.
Questões:
P: Qual é a fórmula do perclorato de cálcio?
R: Ca(ClO4)2.
P: O perclorato de cálcio é iônico ou covalente?
R: Ca(ClO4)2 é um composto iônico porque é composto de cátions de cálcio (Ca2+) e ânions perclorato (ClO4-).
P: Como descarto o perclorato de cálcio?
R: O Ca(ClO4)2 pode ser removido lavando a área afetada com água e, em seguida, neutralizando quaisquer vestígios remanescentes do composto com uma base fraca, como o bicarbonato de sódio.
P: O perclorato de cálcio é solúvel?
R: Sim, Ca(ClO4)2 é solúvel em água e outros solventes polares. Sua solubilidade em água é de aproximadamente 120 g por 100 mL de água em temperatura ambiente.
P: Que reações o perclorato de cálcio e a água produzem?
R: Ca(ClO4)2 e água não reagem entre si em condições normais.
P: Quantos átomos de cloro existem em 0,650 moles de Ca(ClO4)2?
R: Existem 5,88 x 10^23 átomos de cloro em 0,650 moles de Ca(ClO4)2.
P: Qual é a massa molar do Ca(ClO4)2?
R: A massa molar de Ca(ClO4)2 é 238,98 g/mol.
P: Qual é o coeficiente de atividade do H em uma solução contendo 0,073 M de HCl e 0,0090 M de Ca(ClO4)2?
R: O coeficiente de atividade do H em uma solução contendo 0,073 M de HCl e 0,0090 M de Ca(ClO4)2 depende da temperatura e de outros fatores. Pode ser calculado usando modelos termodinâmicos e dados experimentais.
P: Quantos mols existem em 26,0 gramas de Ca(ClO4)2?
R: Existem 0,109 moles de Ca(ClO4)2 em 26,0 gramas do composto.
