Pentacloreto de fósforo é um composto químico com a fórmula PCl5. É usado como reagente em diversas reações químicas. Reage vigorosamente com a água, liberando gás cloreto de hidrogênio.
| Nome IUPAC | Pentacloreto de fósforo |
| Fórmula molecular | PCl5 |
| Número CAS | 10026-13-8 |
| Sinônimos | Pentaclorofosforano, cloreto de fósforo (V), cloreto de fósforo, cloreto de fósforo (V) |
| InChI | InChI=1S/Cl5P/c1-6(2,3,4)5 |
Propriedades do pentacloreto de fósforo
Fórmula de pentacloreto de fósforo
A fórmula do pentacloreto de fósforo é PCl5. Consiste em um átomo de fósforo ligado a cinco átomos de cloro. A fórmula representa a proporção de átomos no composto.
Massa molar de pentacloreto de fósforo
A massa molar do cloreto de fósforo (V) é calculada somando as massas atômicas de todos os seus elementos constituintes. O fósforo tem massa molar de aproximadamente 30,97 gramas por mol e cada átomo de cloro tem massa molar de aproximadamente 35,45 gramas por mol. A sua adição dá uma massa molar de aproximadamente 208,24 gramas por mol de cloreto de fósforo (V).
Ponto de ebulição do pentacloreto de fósforo
O cloreto de fósforo (V) tem um ponto de ebulição de aproximadamente 167,8 graus Celsius. A esta temperatura, o composto sofre uma mudança de fase de líquido para gás. O ponto de ebulição é influenciado pelas forças intermoleculares presentes no composto.
Ponto de fusão do pentacloreto de fósforo
O ponto de fusão do cloreto de fósforo (V) é de aproximadamente -93,6 graus Celsius. Esta é a temperatura na qual o composto muda do estado sólido para o estado líquido. O ponto de fusão é uma propriedade importante na determinação do comportamento físico do composto.
Densidade de pentacloreto de fósforo g/mL
A densidade do cloreto de fósforo (V) é de aproximadamente 2,1 gramas por mililitro. A densidade representa a massa de uma substância por unidade de volume. A densidade do cloreto de fósforo (V) ajuda a compreender seu arranjo e a compactação de suas partículas.
Peso molecular do pentacloreto de fósforo
O peso molecular do cloreto de fósforo (V) é de aproximadamente 208,24 gramas por mol. É a soma dos pesos atômicos de todos os átomos presentes no composto. O peso molecular é útil em vários cálculos, como na determinação da quantidade de substância em uma determinada massa ou volume.
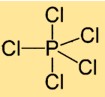
Estrutura do pentacloreto de fósforo
O cloreto de fósforo (V) tem uma estrutura molecular na qual um átomo de fósforo é cercado por cinco átomos de cloro. Os átomos de cloro estão dispostos simetricamente em torno do átomo central de fósforo, formando uma geometria trigonal bipiramidal.
Solubilidade do pentacloreto de fósforo
O cloreto de fósforo (V) é pouco solúvel em água. Reage vigorosamente com a água, liberando gás cloreto de hidrogênio. No entanto, dissolve-se facilmente em solventes polares como benzeno e tetracloreto de carbono. A solubilidade do cloreto de fósforo (V) é influenciada pela polaridade e pelas propriedades químicas do solvente.
| Aparência | Cristais incolores |
| Gravidade Específica | 2,1 g/ml |
| Cor | Incolor |
| Cheiro | Acre |
| Massa molar | 208,24 g/mol |
| Densidade | 2,1 g/ml |
| Ponto de fusão | -93,6ºC |
| Ponto de ebulição | 167,8ºC |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Reage vigorosamente |
| Solubilidade | Solúvel em solventes polares como benzeno e tetracloreto de carbono |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | Não disponível |
| pH | Não aplicável |
Segurança e perigos do pentacloreto de fósforo
O cloreto de fósforo (V) apresenta vários riscos de segurança. É corrosivo e pode causar queimaduras graves na pele, olhos e sistema respiratório em contato. A inalação de seus vapores ou poeira pode causar irritação e danos respiratórios. O composto reage violentamente com a água, liberando gás tóxico cloreto de hidrogênio. Também é muito reativo com materiais orgânicos, podendo causar incêndios ou explosões. Devem ser tomadas precauções apropriadas ao manusear cloreto de fósforo (V), incluindo o uso de equipamentos de proteção como luvas, óculos de proteção e respirador. Deve ser armazenado e manuseado em área bem ventilada, longe de substâncias incompatíveis, para prevenir acidentes e minimizar riscos.
| Símbolos de perigo | Corrosivo |
| Descrição de segurança | Manuseie com depósito. Utilize equipamento de proteção adequado. |
| Números de identificação da ONU | ONU1806 |
| Código SH | 2812.20.00 |
| Classe de perigo | 8 (Substâncias corrosivas) |
| Grupo de embalagem | II (Perigo moderado) |
| Toxicidade | Tóxico por ingestão ou inalação. Pode causar irritação grave. |
Métodos de síntese de pentacloreto de fósforo
Vários métodos permitem a síntese de cloreto de fósforo (V). Um método comum envolve a reação entre tricloreto de fósforo (PCl3) e cloro gasoso (Cl2) . Neste processo, o recipiente de reação combina os compostos e o calor ou um catalisador como o ferro inicia a reação. O gás cloro atua como agente oxidante, convertendo PCl3 em PCl5. A reação prossegue da seguinte forma:
PCl3 + Cl2 → PCl5
Outro método de síntese de cloreto de fósforo (V) envolve a reação entre fósforo e cloro gasoso. Este método é mais direto e envolve a seguinte reação:
P4 + 10Cl2 → 4PCl5
Nesta reação, o fósforo e o cloro gasoso reagem sob condições apropriadas, resultando na formação de cloreto de fósforo (V).
É importante notar que ambos os métodos de síntese requerem um manuseio cuidadoso e precauções de segurança adequadas. As reações envolvem substâncias altamente reativas e corrosivas, portanto são necessários equipamentos de proteção e ventilação adequada. Além disso, é fundamental realizar essas reações em ambiente controlado para prevenir acidentes e garantir a segurança do pessoal envolvido.
Usos do pentacloreto de fósforo
O cloreto de fósforo (V) encontra diversas aplicações devido às suas propriedades e reatividade únicas. Aqui estão alguns de seus usos:
- Síntese química: A síntese orgânica utiliza amplamente o cloreto de fósforo (V) como reagente para converter ácidos carboxílicos em cloretos ácidos e álcoois em cloretos de alquila.
- Produtos farmacêuticos: A síntese de compostos farmacêuticos, incluindo antibióticos e corantes, depende fortemente do cloreto de fósforo (V) como intermediário chave.
- Catalisador: O cloreto de fósforo (V) catalisa diversas reações químicas, como a acilação de Friedel-Crafts e o rearranjo de Beckmann.
- Indústria de polímeros: A produção de vários polímeros, incluindo cloreto de polivinila (PVC) e policarbonatos, utiliza cloreto de fósforo (V) como agente de cloração.
- Aplicações laboratoriais: Em aplicações laboratoriais, o cloreto de fósforo (V) atua como agente secante para remover vestígios de água de aparelhos de laboratório e como agente de cloração e desidratação em diversas reações.
- Herbicidas e Pesticidas: A produção de herbicidas e pesticidas para controlar o crescimento de ervas daninhas e eliminar pragas envolve o uso de cloreto de fósforo (V).
- Agentes de guerra química: Historicamente, o cloreto de fósforo(V) contribuiu ativamente para a produção de agentes de guerra química, mas a sua utilização para tais fins está agora sujeita a regulamentações e restrições rigorosas.
- Tratamento de superfície metálica: Os processos de tratamento de superfície metálica utilizam cloreto de fósforo (V) para melhorar as propriedades de adesão e promover a resistência à corrosão.
- Retardadores de chama: A produção de aditivos retardadores de chama para têxteis, plásticos e outros materiais incorpora cloreto de fósforo (V).
- Fabricação Farmacêutica: O cloreto de fósforo (V) encontra aplicações na produção de diversos produtos farmacêuticos, incluindo a síntese de vitaminas e derivados hormonais.
É importante manusear o cloreto de fósforo (V) com cuidado e seguir os protocolos de segurança adequados devido à sua natureza corrosiva e aos potenciais riscos à saúde.
Questões:
P: Qual é a fórmula correta do pentacloreto de fósforo?
R: A fórmula correta para cloreto de fósforo (V) é PCl5.
P: Qual é a fórmula molecular do pentacloreto de fósforo?
R: A fórmula molecular do cloreto de fósforo (V) é PCl5.
P: Que massa de pentacloreto de fósforo seria produzida pela reação completa de 15,2 g de P4?
R: A massa de cloreto de fósforo (V) produzida seria de aproximadamente 208,24 g.
P: Qual é a forma do pentacloreto de fósforo?
R: A forma do cloreto de fósforo (V) é trigonal bipiramidal.
P: Qual é a massa de uma molécula de pentacloreto de fósforo?
R: A massa de uma molécula de cloreto de fósforo (V) é de aproximadamente 208,24 gramas por mol.
P: Propriedades do pentacloreto de fósforo?
R: O cloreto de fósforo (V) é corrosivo, reage violentamente com a água e é usado como reagente em síntese química.
P: Ângulos de ligação do cloreto de fósforo (V)?
R: Os ângulos de ligação no pentacloreto de fósforo são de aproximadamente 120 graus (entre átomos de cloro equatoriais) e 90 graus (entre átomos de cloro axiais).
P: Como fazer pentacloreto de fósforo?
R: O cloreto de fósforo (V) pode ser produzido pela reação do tricloreto de fósforo (PCl3) com cloro gasoso (Cl2) ou pela reação direta entre fósforo e cloro gasoso.
P: Qual é a geometria eletrônica do fósforo no pentacloreto de fósforo?
R: A geometria eletrônica do fósforo no cloreto de fósforo (V) é trigonal bipiramidal.
