O óxido de níquel (II) é um composto químico com a fórmula NiO. É um sólido preto, comumente utilizado como catalisador e na produção de cerâmicas e pigmentos.
| Nome IUPAC | Óxido de níquel (II) |
| Fórmula molecular | NiO |
| Número CAS | 1313-99-1 |
| Sinônimos | Óxido de níquel, monóxido de níquel, óxido de Ni(II) |
| InChI | InChI=1S/Ni.O |
Propriedades do óxido de níquel (II)
Fórmula de óxido de níquel (II)
A fórmula química do monóxido de níquel é NiO. Consiste em um átomo de níquel (Ni) e um átomo de oxigênio (O), resultando em uma fórmula simples e direta.
Óxido de Níquel (II) Massa molar
A massa molar do monóxido de níquel pode ser calculada somando as massas atômicas de seus elementos constituintes. Para NiO, a massa molar é de aproximadamente 74,69 gramas por mol (g/mol).
Ponto de ebulição do óxido de níquel (II)
O monóxido de níquel não tem um ponto de ebulição distinto porque sofre decomposição antes de atingir o seu ponto de ebulição. Quando aquecido, ele se decompõe em seus elementos constituintes, níquel e oxigênio.
Ponto de fusão de óxido de níquel (II)
O ponto de fusão do monóxido de níquel é de aproximadamente 1984 graus Celsius (1984 °C). A esta temperatura, o NiO sólido se transforma em estado líquido.
Densidade do óxido de níquel(II) g/mL
A densidade do monóxido de níquel é de aproximadamente 6,67 gramas por mililitro (g/mL). Este valor indica a quantidade de massa compactada em um determinado volume, tornando-se uma medida da compactação da substância.
Peso molecular do óxido de níquel (II)
O peso molecular do monóxido de níquel é calculado somando os pesos atômicos de seus elementos constituintes. Para NiO, o peso molecular é de aproximadamente 74,69 gramas por mol (g/mol).
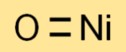
Estrutura do óxido de níquel (II)
O monóxido de níquel tem uma estrutura cristalina cúbica. Consiste em íons de níquel (Ni2+) e íons de óxido (O2-) dispostos em um padrão regular e repetido. Essa estrutura contribui para suas propriedades e comportamento característicos.
Solubilidade do óxido de níquel (II)
O monóxido de níquel é pouco solúvel em água. Tem solubilidade limitada, o que significa que se dissolve apenas em pequena extensão na água. No entanto, pode reagir com ácidos para formar sais solúveis de níquel, exibindo um certo grau de reatividade química.
| Aparência | Preto sólido |
| Gravidade Específica | 6,67g/ml |
| Cor | Preto |
| Cheiro | Inodoro |
| Massa molar | 74,69 g/mol |
| Densidade | 6,67g/ml |
| Ponto de fusão | 1984°C |
| Ponto de ebulição | Decomposto |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Pouco solúvel |
| Solubilidade | Solúvel em ácidos, forma sais solúveis de níquel |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | Não aplicável |
| pH | Neutro |
Observe que algumas propriedades, como ponto de fulgor, pressão de vapor e pKa, não são aplicáveis ou não estão disponíveis para monóxido de níquel.
Segurança e perigos do óxido de níquel (ii)
O monóxido de níquel apresenta certas considerações de segurança e perigos. É importante manuseá-lo com cuidado. Deve-se evitar o contato direto com a pele, os olhos ou a inalação de poeira ou vapor. Isto pode causar irritação na pele e reações alérgicas em algumas pessoas. Se ingerido ou inalado, é necessária atenção médica imediata. O monóxido de níquel não é considerado altamente inflamável, mas pode contribuir para um incêndio se exposto a materiais combustíveis. É importante armazená-lo e manuseá-lo em local bem ventilado. Equipamentos de proteção individual adequados, como luvas e óculos de proteção, devem ser usados ao trabalhar com monóxido de níquel para minimizar riscos potenciais.
| Símbolos de perigo | Nenhum |
| Descrição de segurança | Manuseie com cuidado. Evite contato direto e inalação. Utilize equipamento de proteção adequado. Procure atendimento médico, se necessário. |
| Números de identificação da ONU | Não aplicável |
| Código SH | 2825.70.10 |
| Classe de perigo | Não classificado |
| Grupo de embalagem | Não classificado |
| Toxicidade | Considerado prejudicial se ingerido ou inalado. Pode causar irritação na pele e reações alérgicas. |
Observe que o monóxido de níquel não possui símbolos de perigo específicos, identificadores da ONU, classe de perigo ou grupo de embalagem. As informações de segurança fornecidas baseiam-se no conhecimento geral e nas precauções associadas ao manuseio e uso do monóxido de níquel. É essencial consultar fichas de dados de segurança (SDS) específicas e seguir as práticas de segurança recomendadas para obter informações precisas e detalhadas.
Métodos para a síntese de óxido de níquel (ii)
Existem vários métodos para sintetizar monóxido de níquel. Uma abordagem comum é a decomposição térmica de compostos de níquel, como carbonato de níquel ou hidróxido de níquel. Neste método, aquece-se um composto precursor específico na ausência de oxigênio para formar monóxido de níquel.
Outro método envolve a oxidação do níquel metálico. O níquel metálico pode reagir com o oxigênio ou o ar em altas temperaturas para produzir monóxido de níquel. Execute este processo calcinando ou torrando o níquel metálico em uma atmosfera de ar ou oxigênio para produzir monóxido de níquel.
Use reações de precipitação para sintetizar monóxido de níquel fazendo reagir sais de níquel, como cloreto de níquel ou nitrato de níquel, com uma solução alcalina como hidróxido de sódio ou hidróxido de amônio . Esta reação forma um precipitado de monóxido de níquel.
A síntese sol-gel é outro método viável. Isto envolve a hidrólise e condensação de precursores de níquel adequados, tais como alcóxidos de níquel, numa solução. Obtenha monóxido de níquel secando e calcinando o gel formado durante a reação de precipitação.
Utilizar técnicas de eletrodeposição para a síntese de monóxido de níquel. Ao aplicar uma corrente elétrica a um eletrodo de níquel imerso em uma solução eletrolítica, o monóxido de níquel pode se formar na superfície do eletrodo.
Ao escolher um método de síntese, fatores como pureza desejada, escalabilidade e requisitos específicos de aplicação devem ser considerados, pois cada método oferece suas próprias vantagens.
Usos do óxido de níquel (ii)
O monóxido de níquel encontra vários usos em diferentes indústrias devido às suas propriedades únicas. Aqui estão algumas de suas aplicações comuns:
- Catalisador: O monóxido de níquel catalisa ativamente diversas reações químicas, como processos de hidrogenação e oxidação, facilitando a conversão de reagentes em produtos desejados.
- Cerâmica: Na produção de materiais cerâmicos, o monóxido de níquel funciona ativamente como agente corante, contribuindo ativamente para a obtenção de cores e padrões específicos em esmaltes e pigmentos cerâmicos.
- Baterias: As baterias recarregáveis de níquel-cádmio (NiCd) e níquel-hidreto metálico (NiMH) usam ativamente monóxido de níquel como material de eletrodo positivo, permitindo ativamente o armazenamento e a liberação de energia elétrica.
- Sensores de gás: O monóxido de níquel detecta ativamente gases como monóxido de carbono (CO) e dióxido de nitrogênio (NO2) em aplicações de detecção de gás quando usado em sensores baseados nele.
- Fabricação de vidro: A indústria do vidro utiliza ativamente o monóxido de níquel para conferir diversas cores aos produtos de vidro, contribuindo ativamente para a produção de vidro colorido, incluindo tons verdes, marrons e pretos.
- Revestimentos Condutivos: O monóxido de níquel funciona ativamente como um componente em revestimentos condutores, que tornam materiais como vidro ou plásticos ativamente condutores quando aplicados a eles.
- Células a combustível: O monóxido de níquel funciona ativamente como um componente de células a combustível de óxido sólido (SOFCs), atuando ativamente como um material catódico e participando de reações eletroquímicas dentro da célula a combustível.
- Suporte Catalisador: O monóxido de níquel serve ativamente como material de suporte para outros catalisadores, melhorando ativamente sua estabilidade e desempenho.
A diversificada gama de aplicações do monóxido de níquel destaca sua importância em diversas indústrias, destacando sua utilidade e versatilidade.
Questões:
P: Qual é a fórmula do óxido de níquel (II)?
R: A fórmula do óxido de níquel (II) é NiO.
P: Que sal é formado quando o óxido de níquel (II) reage com o ácido nítrico?
R: A reação do óxido de níquel (II) com ácido nítrico forma nitrato de níquel (II) (Ni (NO3) 2).
P: Em que voltagem o níquel (II) se oxida em níquel (III)?
R: O níquel(II) oxida em níquel(III) a uma voltagem de aproximadamente +1,63V.
P: O que acontece quando o Ni(s) é oxidado em íon níquel(II), conforme mostrado na imagem?
R: Durante a oxidação do íon Ni(s) em íon níquel(II), elétrons são perdidos, resultando na formação de íons Ni2+.
P: Que massas de óxido de níquel (II) e alumínio devem ser usadas para produzir 13,3 g de níquel?
R: As massas de óxido de níquel (II) e alumínio necessárias para produzir 13,3 g de níquel dependem da reação específica e da estequiometria envolvida.
