O óxido de amônio ((NH4)2O) é um composto cristalino branco solúvel em água e atua como uma base fraca. É produzido pela reação de amônia e oxigênio e é utilizado em fertilizantes, agentes de limpeza e como extintor de incêndio.
| Nome IUPAC | Óxido de amônio |
| Fórmula molecular | (NH4)2O |
| Número CAS | 12046-03-6 |
| Sinônimos | Hidróxido de amônio, solução de amônia, Aqua Amônia |
| InChI | InChI=1S/H4N.O/h1H4;/q+1;-1 |
Propriedades do óxido de amônio
Fórmula de Óxido de Amônio
A fórmula do óxido de amônio é (NH4)2O. É um composto composto por um átomo de nitrogênio e quatro átomos de hidrogênio combinados com um átomo de oxigênio.
Massa molar de óxido de amônio
A massa molar do óxido de amônio é de aproximadamente 52,07 gramas por mol. É calculado somando os pesos atômicos de todos os átomos presentes na molécula. A massa molar ajuda a determinar o número de partículas presentes em uma determinada quantidade de uma substância.
Ponto de ebulição do óxido de amônio
O ponto de ebulição do (NH4)2O é aproximadamente 90°C. É a temperatura na qual a pressão de vapor de um líquido se iguala à pressão ao seu redor, fazendo com que o líquido se transforme em gás. O ponto de ebulição de uma substância é uma propriedade física importante que pode ser usada para identificar e distinguir diferentes compostos.
Ponto de fusão do óxido de amônio
O ponto de fusão do (NH4)2O é aproximadamente -6°C. Esta é a temperatura na qual um sólido se transforma em líquido. O ponto de fusão de uma substância pode ser usado para identificar e distinguir diferentes compostos, bem como para determinar a pureza de uma substância.
Densidade de óxido de amônio g/ml
A densidade de (NH4)2O é de aproximadamente 1,02 g/ml. Densidade é a quantidade de massa por unidade de volume e é uma propriedade física fundamental de uma substância. A densidade de uma substância pode ser usada para identificar e distinguir diferentes compostos, bem como para determinar a pureza de uma substância.
Peso molecular do óxido de amônio
O peso molecular do óxido de amônio é de aproximadamente 52,07 g/mol. É a soma dos pesos atômicos de todos os átomos presentes em uma molécula da substância. O peso molecular pode ser usado para calcular os moles de uma substância presente em uma determinada massa e é uma importante propriedade física usada em muitos campos da ciência.
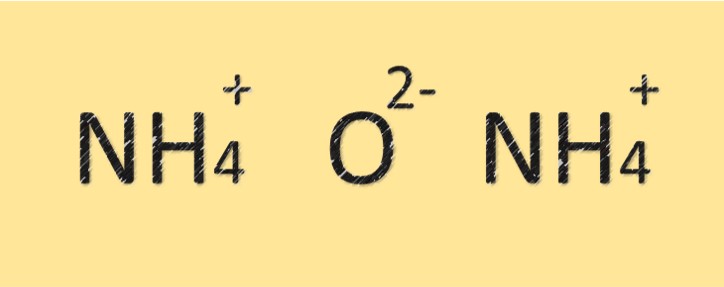
Estrutura do óxido de amônio
O óxido de amônio é um composto formado por átomos de nitrogênio e oxigênio. Tem fórmula molecular (NH4)2O e é composto por dois átomos de nitrogênio e um átomo de oxigênio. O átomo de nitrogênio está ligado ao átomo de oxigênio por uma ligação covalente e também possui carga positiva. O composto possui caráter básico ou alcalino devido à presença do íon amônio.
| Aparência | Sólido cristalino branco |
| Gravidade Específica | 1,02g/cm³ |
| Cor | Branco |
| Cheiro | Amônia |
| Massa molar | 52,07 g/mol |
| Densidade | 1,02g/cm³ |
| Ponto de fusão | -6ºC |
| Ponto de ebulição | 90°C |
| Ponto flash | N / D |
| Solubilidade em Água | Solúvel |
| Solubilidade | Solúvel em água |
| Pressão de vapor | N / D |
| Densidade do vapor | N / D |
| pKa | N / D |
| pH | 11,6 (100 g/L, H2O, 20°C) |
Segurança e perigos do óxido de amônio
(NH4)2O é irritante para os olhos, pele e sistema respiratório. A inalação de seus vapores pode causar tosse, falta de ar e irritação pulmonar. O contato com a pele pode causar coceira e vermelhidão. O composto deve ser manuseado com cautela e devem ser utilizadas medidas de proteção, como luvas e proteção para os olhos. Se expostas, as áreas afetadas devem ser enxaguadas com água e deve-se procurar atendimento médico se os sintomas persistirem. Também é inflamável e deve ser mantido longe de fontes de ignição.
| Símbolos de perigo | Irritante |
| Descrição de segurança | S26-S36/37/39 |
| Números de identificação da ONU | UN2672 |
| Código SH | 2841.90.90 |
| Classe de perigo | 8 |
| Grupo de embalagem | III |
| Toxicidade | Irritante para os olhos, pele e sistema respiratório |
Métodos para a síntese de óxido de amônio
(NH4)2O pode ser sintetizado por vários métodos, incluindo a decomposição térmica do nitrato de amônio e a reação entre o gás amônia e o gás oxigênio.
Um método envolve a decomposição térmica do nitrato de amônio, que é um fertilizante comum. A reação produz amônia e dióxido de nitrogênio, que são então oxidados em dióxido de nitrogênio e óxido nítrico. O óxido nítrico reage com mais gás amônia para formar (NH4)2O.
Outro método envolve a passagem de gás amônia sobre um catalisador aquecido, fazendo com que os átomos de nitrogênio e oxigênio se combinem e formem (NH4)2O. Ambos os métodos produzem (NH4)2O como um sólido cristalino branco, que pode ser purificado por recristalização.
Usos do óxido de amônio
As indústrias utilizam (NH4)2O para diversos fins devido ao seu alto teor de amônio e fortes propriedades alcalinas. Como fertilizante, fornece uma fonte de nitrogênio para as plantas. Os agentes de limpeza utilizam-no para dissolver gordura e sujeira. A indústria metalúrgica utiliza-o como agente redutor de óxidos metálicos, principalmente na produção de alumínio. Como refrigerante, é utilizado em sistemas de refrigeração industrial e como fonte de nitrogênio na produção de ácido nítrico. No laboratório, os químicos o utilizam como fonte de amônia para reações químicas. A versatilidade do (NH4)2O torna-o um produto químico valioso com múltiplas aplicações em todos os setores.
