O oxicloreto de fósforo (POCl3) é um composto químico utilizado em diversos processos industriais. Reage com a água para formar ácido fosfórico e ácido clorídrico.
| Nome IUPAC | Oxicloreto de fósforo |
| Fórmula molecular | POCl3 |
| Número CAS | 10025-87-3 |
| Sinônimos | Cloreto de fosforil, tricloreto de fosforil, tricloreto de fósforo |
| InChI | InChI=1S/Cl3OP/c1-4(2)3 |
Propriedades do oxicloreto de fósforo
Fórmula de oxicloreto de fósforo
A fórmula química do cloreto de fosforil é POCl3. É composto por um átomo de fósforo (P), simbolizado por P, e três átomos de cloro (Cl), simbolizados por Cl. A fórmula indica a proporção de cada elemento presente no composto.
Massa molar de oxicloreto de fósforo
A massa molar do cloreto de fosforil pode ser calculada somando as massas atômicas de seus elementos constituintes. O fósforo tem massa molar de 30,97 g/mol, enquanto o cloro tem massa molar de 35,45 g/mol. Multiplicar a massa molar do cloro por 3 e adicionar a massa molar do fósforo dá uma massa molar total de aproximadamente 153,33 g/mol para o cloreto de fosforil.
Ponto de ebulição do oxicloreto de fósforo
O cloreto de fosforil tem um ponto de ebulição de aproximadamente 105,5°C. Esta temperatura representa o ponto em que o composto líquido muda para o estado gasoso sob pressão atmosférica padrão. O ponto de ebulição é uma característica importante que afeta o manuseio e aplicação do cloreto de fosforil.
Ponto de fusão do oxicloreto de fósforo
O ponto de fusão do cloreto de fosforil é de aproximadamente -112,5°C. Isto significa a temperatura na qual o composto sólido muda para o estado líquido. O ponto de fusão é um parâmetro crítico para considerações de armazenamento e transporte.
Densidade de oxicloreto de fósforo g/mL
A densidade do cloreto de fosforil é de aproximadamente 1,65 g/mL. Densidade refere-se à quantidade de massa por unidade de volume de uma substância. Uma densidade mais alta sugere uma concentração maior de partículas em um determinado volume.
Peso molecular do oxicloreto de fósforo
O peso molecular do cloreto de fosforil é calculado somando as massas atômicas de seus elementos constituintes. O peso molecular do fósforo é de aproximadamente 30,97 g/mol, enquanto o cloro tem peso molecular de 35,45 g/mol. A adição das massas ponderadas dá um peso molecular aproximado de 153,33 g/mol para cloreto de fosforil.
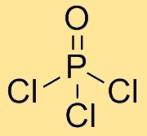
Estrutura do oxicloreto de fósforo
O cloreto de fosforil tem uma estrutura molecular na qual um átomo de fósforo está ligado a três átomos de cloro e um átomo de oxigênio. Os átomos de cloro estão dispostos simetricamente em torno do átomo central de fósforo, com o átomo de oxigênio também ligado ao átomo de fósforo. Este arranjo forma uma geometria tetraédrica.
Solubilidade do oxicloreto de fósforo
O cloreto de fosforil é pouco solúvel em água, mas se dissolve facilmente em solventes orgânicos como benzeno, tetracloreto de carbono e clorofórmio. Seu comportamento de solubilidade é atribuído à natureza polar da molécula e à presença de átomos eletronegativos como oxigênio e cloro.
| Aparência | Líquido incolor |
| Gravidade Específica | 1.645g/ml |
| Cor | Incolor |
| Cheiro | Acre |
| Massa molar | 153,33 g/mol |
| Densidade | 1.645g/ml |
| Ponto de fusão | -112,5ºC |
| Ponto de ebulição | 105,5°C |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Reage vigorosamente |
| Solubilidade | Solúvel em solventes orgânicos como benzeno, tetracloreto de carbono e clorofórmio |
| Pressão de vapor | 11 mmHg a 20°C |
| Densidade do vapor | 5,29 (Ar = 1) |
| pKa | Não aplicável |
| pH | Não aplicável |
Segurança e perigos do oxicloreto de fósforo
O cloreto de fosforil representa riscos à segurança e requer manuseio cuidadoso. É corrosivo para a pele, olhos e sistema respiratório. O contato pode causar queimaduras graves e lesões oculares. A inalação de seus fumos ou vapores pode irritar o trato respiratório. Equipamentos de proteção individual adequados, como luvas e óculos de proteção, devem ser usados ao trabalhar com este composto. Deve ser armazenado em área bem ventilada, longe de fontes de ignição. Se exposto, é necessária atenção médica imediata. Além disso, deve ser manuseado sob uma capela para evitar a liberação de vapores tóxicos.
| Símbolos de perigo | Corrosivo, Perigo |
| Descrição de segurança | Corrosivo. Causa queimaduras na pele e lesões oculares graves. Pode ser prejudicial se inalado ou engolido. Evite contato e inalação. |
| Números de identificação da ONU | Um 1810 |
| Código SH | 2812.10.00 |
| Classe de perigo | Classe 8 (substâncias corrosivas) |
| Grupo de embalagem | Grupo de embalagem III (risco menor) |
| Toxicidade | O cloreto de fosforil é tóxico e pode causar sérios efeitos à saúde. |
Métodos para a síntese de oxicloreto de fósforo
O cloreto de fosforil pode ser sintetizado por vários métodos. Um método comum envolve a reação entre tricloreto de fósforo (PCl3) e oxigênio (O2). Neste processo, o PCl3 é aquecido na presença de excesso de oxigênio para formar cloreto de fosforil. A reação é exotérmica e geralmente ocorre em um ambiente controlado, tal como um vaso reator.
Outro método de síntese envolve a reação entre pentóxido de fósforo (P2O5) e tricloreto de fósforo. O P2O5 atua como agente desidratante e, quando combinado com PCl3 , forma cloreto de fosforil.
Além disso, o cloreto de fosforil pode ser sintetizado pela reação do tribrometo de fósforo (PBr3) e do pentóxido de fósforo. Esta reação leva à formação de cloreto de fosforil e pentabrometo de fósforo.
Além disso, a cloração direta do fósforo também pode produzir cloreto de fosforil. Neste processo, o gás cloro passa sobre o fósforo aquecido, resultando na formação de cloreto de fosforil.
É importante notar que estes métodos sintéticos devem ser realizados com cautela devido à reatividade e natureza perigosa dos compostos envolvidos. Protocolos de segurança adequados, incluindo o uso de equipamento de proteção e condições de reação controladas, devem ser seguidos para garantir o manuseio e a síntese seguros do cloreto de fosforil.
Usos do oxicloreto de fósforo
O cloreto de fosforil encontra diversas aplicações em diferentes indústrias devido às suas propriedades únicas. Aqui estão alguns usos comuns:
- Síntese química: A química orgânica utiliza amplamente o cloreto de fosforil como um reagente versátil para produzir vários compostos, incluindo ácidos fosfônicos, ésteres e amidas.
- Agroquímicos: A síntese de pesticidas e herbicidas na proteção de culturas e no controle de pragas tem o cloreto de fosforil como ingrediente-chave, desempenhando um papel crucial.
- Indústria farmacêutica: A fabricação de intermediários farmacêuticos e insumos farmacêuticos ativos (APIs) utiliza cloreto de fosforil, facilitando a síntese de medicamentos importantes como antimaláricos e antiinflamatórios.
- Indústria de polímeros: Na produção de polímeros, o cloreto de fosforil atua como catalisador e agente de cloração, contribuindo para a síntese de aditivos retardadores de chama que melhoram a resistência ao fogo dos materiais.
- Fabricação de corantes e pigmentos: O cloreto de fosforil tem aplicação na produção de corantes e pigmentos, principalmente na preparação de cloroalquil fosfonatos, compostos essenciais para o desenvolvimento de corantes utilizados em têxteis, tintas e revestimentos.
- Reagente de Laboratório: Vários procedimentos laboratoriais utilizam cloreto de fosforil como reagente, incluindo a conversão de álcoois em cloretos de alquila e a preparação de agentes fosforilantes.
- Tratamento de Água: Os processos de tratamento de água utilizam cloreto de fosforil como agente acidificante e desinfetante para controlar os níveis de pH e remover impurezas.
- Retardadores de chama: O cloreto de fosforil desempenha um papel na produção de materiais retardadores de chama, melhorando as propriedades de segurança contra incêndio de têxteis, plásticos e materiais de construção.
Estas diversas aplicações demonstram a importância do cloreto de fosforil em muitos setores industriais, destacando o seu papel crucial na síntese química, na agricultura, na indústria farmacêutica e na ciência dos materiais.
Questões
P: Qual é a geometria molecular do POCl3?
R: A geometria molecular do POCl3 é trigonal piramidal.
P: Qual é o principal alceno formado quando o composto A é desidratado com POCl3 e piridina?
R: O principal alceno formado durante a desidratação do composto A com POCl3 e piridina depende da estrutura específica do composto A.
P: O POCl3 é polar ou apolar
R: POCl3 é uma molécula polar devido à presença de ligações polares e uma forma molecular assimétrica.
P: Quanto gás POCl3 pode ser produzido?
R: O volume de gás POCl3 produzido depende das quantidades de reagentes e das condições específicas de reação.
P: Quantos moles de POCl3 existem em 10,0 gramas de POCl3?
R: Existem aproximadamente 0,082 moles de POCl3 em 10,0 gramas de POCl3.
P: Qual é a geometria do par de elétrons para P em POCl3?
R: A geometria do par de elétrons para P em POCl3 é tetraédrica.
P: O POCl3 tem um momento dipolar?
R: Sim, o POCl3 possui momento dipolar devido à presença de ligações polares e à sua geometria molecular.
P: O POCl3 tem ressonância?
R: Não, o POCl3 não exibe ressonância porque não há elétrons deslocalizados ou múltiplas estruturas de ressonância.
P: Qual é a geometria do domínio eletrônico em torno do átomo de oxigênio no POCl3?
R: A geometria do domínio eletrônico em torno do átomo de oxigênio no POCl3 é trigonal piramidal.
P: Que volume de H3PO4 se formará quando 72,3 mililitros de POCl3 reagirem completamente?
R: O volume de H3PO4 formado quando 72,3 mililitros de POCl3 reagem completamente depende da estequiometria da reação e não pode ser determinado com base apenas nas informações fornecidas.
