O nitrito de sódio (NaNO2) é um composto químico comumente usado como conservante de alimentos para prevenir o crescimento bacteriano e realçar a cor e o sabor de carnes curadas, como bacon e cachorro-quente.
| Nome IUPAC | Nitrito de sódio |
| Fórmula molecular | NaNO2 |
| Número CAS | 7632-00-0 |
| Sinônimos | Ácido nitroso, sal de sódio; E250; Natriumnitrito; Nitrito de sódio; Nitrito de sódio; ONU 1500 |
| InChI | InChI=1S/NO2.Na/c2-1-3;/q-1;+1 |
Propriedades do nitrito de sódio
Fórmula de nitrito de sódio
A fórmula química do nitrito de sódio é NaNO2. Isto indica que um mol de nitrito de sódio contém um cátion de sódio, um átomo de nitrogênio e dois átomos de oxigênio. A fórmula é usada para representar a composição de uma substância e pode ser usada para prever as reações que uma substância pode sofrer.
Massa molar de nitrito de sódio
O NaNo2 tem massa molar de 69,0 g/mol. Esta é a massa de um mol de NaNo2, que é a quantidade de substância contendo 6,02 x 10 ^ 23 moléculas individuais do composto. A massa molar é uma propriedade física importante usada para calcular várias propriedades químicas e físicas de uma substância.
Ponto de ebulição do nitrito de sódio
O ponto de ebulição do NaNo2 é 320°C (608°F). Esta é a temperatura na qual o NaNo2 mudará de líquido para gás. O ponto de ebulição é uma propriedade importante porque pode afetar o modo como uma substância é usada em diversas aplicações industriais, como a produção de corantes, pigmentos e produtos farmacêuticos.
Ponto de fusão do nitrito de sódio
O ponto de fusão do NaNo2 é 271°C (520°F). Esta é a temperatura na qual o NaNo2 mudará de sólido para líquido. O ponto de fusão é uma propriedade importante porque pode afetar a estabilidade e a reatividade de uma substância em diferentes temperaturas.
Densidade de nitrito de sódio g/mL
A densidade do NaNo2 é 2,168 g/mL. Densidade é a massa por unidade de volume de uma substância e pode ser usada para determinar a concentração de uma solução. A densidade do NaNo2 também pode ser usada para determinar a pureza de uma amostra.
Peso molecular do nitrito de sódio
O peso molecular do NaNo2 é 69,0 g/mol. É a soma dos pesos atômicos de todos os átomos de uma molécula do composto. O peso molecular é uma propriedade importante usada para calcular várias propriedades químicas e físicas de uma substância.
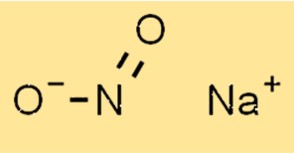
Estrutura do nitrito de sódio
A estrutura do NaNo2 é composta por um cátion sódio (Na+) e um ânion nitrito (NO2-). O ânion nitrito tem uma geometria trigonal planar com um átomo de nitrogênio e dois átomos de oxigênio. O cátion sódio está localizado no centro do ânion nitrito.
Solubilidade do nitrito de sódio
O NaNo2 é solúvel em água, com solubilidade de 820 g/L a 20°C. Solubilidade é a quantidade máxima de uma substância que pode ser dissolvida em uma determinada quantidade de solvente a uma determinada temperatura. A solubilidade do NaNo2 pode ser afetada por fatores como temperatura e presença de outros solutos.
| Aparência | Pó cristalino branco a ligeiramente amarelado |
| Gravidade Específica | 2.168g/mL |
| Cor | Branco a ligeiramente amarelado |
| Cheiro | Inodoro |
| Massa molar | 69,0 g/mol |
| Densidade | 2.168g/mL |
| Ponto de fusão | 271°C (520°F) |
| Ponto de ebulição | 320°C (608°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | 820 g/L a 20°C |
| Solubilidade | Solúvel em etanol e glicerol |
| Pressão de vapor | 1,33kPa a 20°C |
| Densidade do vapor | 2,3 (ar = 1) |
| pKa | 3,34 |
| pH | 7-8 (solução a 10%) |
Segurança e perigos do nitrito de sódio
O NaNo2 pode representar uma série de perigos para a saúde humana e para o ambiente. É considerado tóxico se ingerido, inalado ou absorvido pela pele e pode causar metemoglobinemia, condição na qual o sangue não consegue transportar oxigênio para os tecidos do corpo. O NaNo2 também pode ser irritante para os olhos, pele e sistema respiratório. É importante manusear o NaNo2 com cautela, utilizando equipamento de proteção individual adequado e seguindo os procedimentos adequados de manuseio e descarte. Além disso, o NaNo2 pode representar um risco para o meio ambiente se não for contido e descartado adequadamente.
| Símbolos de perigo | T+,C |
| Descrição de segurança | Manter afastado de materiais combustíveis. Não respirar poeiras/fumos/gases/névoas/vapores/aerossóis. Use luvas/roupas de proteção e proteção para os olhos/face. Em caso de incêndio: Use CO2, pó químico ou espuma para extinguir. Descarte o conteúdo/recipiente de acordo com os regulamentos locais/regionais/nacionais/internacionais. |
| Números de identificação da ONU | ONU1500 |
| Código SH | 283410 |
| Classe de perigo | 5.1 |
| Grupo de embalagem | II |
| Toxicidade | Muito tóxico por ingestão, inalação e absorção pela pele. Pode causar metemoglobinemia. Irritante para os olhos, pele e sistema respiratório. |
Métodos para a síntese de nitrito de sódio
Existem vários métodos para sintetizar NaNo2.
Um método comum é reagir ácido nítrico e hidróxido de sódio , que produz nitrato de sódio. Um agente redutor como o ferro ou o zinco reduz o nitrato de sódio, formando NaNo2.
Outro método envolve a reação do nitrato de sódio com ácido clorídrico , produzindo uma mistura de ácido nítrico e cloreto de sódio. O hidróxido de sódio reage com o ácido nítrico para produzir NaNo2.
A síntese de NaNo2 pode ocorrer através da reação entre amônia e nitrato de sódio , que produz NaNo2 e água como produtos.
O processo de fabricação de ácido nítrico produz NaNo2 como subproduto enquanto oxida amônia no processo.
Usos do nitrito de sódio
O NaNo2 tem vários usos em diversas indústrias, alguns dos quais incluem:
- Preservação de Alimentos: Comumente usado como conservante de alimentos, especialmente em carnes curadas como bacon e cachorro-quente. Ajuda a prevenir o crescimento de bactérias nocivas e preserva a cor e o sabor da carne.
- Aplicações Industriais: Utilizado em diversas aplicações industriais, como processamento de metais e como inibidor de corrosão. Também utilizado na produção de corantes e outros produtos químicos.
- Aplicações Médicas: Usado medicinalmente para tratar o envenenamento por cianeto porque converte a hemoglobina em metemoglobina, que pode se ligar aos íons cianeto e impedir que eles se liguem à hemoglobina.
- Tratamento de Água: Usado no tratamento de água para controlar o crescimento de bactérias e algas nocivas em sistemas de água.
- Agricultura: Usado na agricultura como fertilizante, ajudando a melhorar o rendimento e a qualidade das colheitas.
- Fotografia: Usado em fotografia como agente de revelação.
Questões:
P: O que é nitrito de sódio?
R: NaNo2 é um composto químico com a fórmula NaNO2. É um pó cristalino branco ou levemente amarelado comumente utilizado como conservante de alimentos e em diversas aplicações industriais.
P: Quem descobriu o nitrito de sódio?
R: O NaNO2 foi descoberto pela primeira vez em 1805 pelo químico francês Louis Nicolas Vauquelin.
P: O nitrito de sódio é ruim para você?
R: O consumo excessivo de NaNo2 pode ser prejudicial à saúde humana. Tem sido associada a problemas de saúde como o cancro e a metemoglobinemia, uma doença na qual o sangue é incapaz de transportar oxigénio de forma eficaz. No entanto, quando utilizado em quantidades regulamentadas e limitadas, o NaNo2 é considerado seguro para consumo.
P: Qual é a fórmula do nitrito de sódio?
R: A fórmula do nitrito de sódio é NaNO2.
P: O nitrito de sódio é seguro?
R: O NaNo2 é geralmente considerado seguro para consumo quando usado em quantidades regulamentadas e limitadas. Porém, o consumo excessivo pode ser prejudicial à saúde humana.
P: Como fazer nitrito de sódio?
R: O NaNo2 pode ser sintetizado por vários métodos, como a reação do ácido nítrico e do hidróxido de sódio, a reação do nitrato de sódio com ácido clorídrico e a reação da amônia com nitrato de sódio. No entanto, a síntese de NaNo2 deve ser realizada com cautela, pois envolve a utilização de produtos químicos perigosos e exige a tomada de medidas de segurança adequadas.
P: O nitrito de sódio é um oxidante?
R: Sim, o NaNo2 é um oxidante. É comumente usado em pirotecnia como agente oxidante.
P: Como o nitrito de sódio afeta a cor da carne?
R: O NaNO2 é comumente usado como conservante de alimentos em carnes curadas, como bacon e cachorros-quentes. Ajuda a preservar a cor da carne, inibindo o crescimento de bactérias nocivas que podem causar descoloração.
P: Como o NaNO2 e o NaNO3 são produzidos comercialmente?
R: NaNO3 e NaNO2 são produzidos comercialmente por vários métodos, como a oxidação da amônia e a reação do hidróxido de sódio com ácido nítrico. São utilizados em diversas aplicações industriais, médicas e agrícolas, bem como na preservação de alimentos.
