Nitrito de cálcio (Ca(NO2)2) é um composto químico comumente usado como inibidor de corrosão em concreto. Ajuda a prevenir a corrosão dos reforços de aço.
| Nome da IUPAC | Dinitrito de cálcio |
| Fórmula molecular | Ca(NO2)2 |
| Número CAS | 13780-06-8 |
| Sinônimos | Nitrito de cálcio di-hidratado, ácido nitroso, sal de cálcio, ácido nítrico, sal de cálcio, di-hidratado, etc. |
| InChI | InChI=1S/Ca.2HNO2/c;2 2-1-3/h;2 (H,2,3) |
Propriedades do nitrito de cálcio
Fórmula de nitrito de cálcio
A fórmula química do nitrito de cálcio é Ca(NO2)2. Esta fórmula indica que o composto contém dois ânions nitrito para cada cátion cálcio. A fórmula é importante na determinação da composição do composto e na determinação da quantidade de cada elemento no composto.
Massa molar de nitrito de cálcio
A massa molar do Ca(NO2)2, também conhecido como dinitrito de cálcio, é de aproximadamente 132,09 g/mol. É um composto iônico composto por cátions de cálcio e ânions nitrito. A massa molar é calculada somando as massas atômicas dos elementos constituintes do composto, que neste caso são cálcio, nitrogênio e oxigênio.
Ponto de ebulição do nitrito de cálcio
Ca(NO2)2 tem um alto ponto de ebulição de cerca de 400°C (752°F). Este alto ponto de ebulição é devido às fortes ligações iônicas que existem entre os íons Ca2+ e NO2- no composto. Quando o Ca(NO2)2 é aquecido, ele sofre decomposição térmica, liberando dióxido de nitrogênio e oxigênio.
Ponto de fusão do nitrito de cálcio
Ca(NO2)2 tem um ponto de fusão de aproximadamente 132°C (270°F). Este ponto de fusão é relativamente baixo em comparação com outros compostos iônicos, como o cloreto de sódio, que tem um ponto de fusão de 801°C (1.474°F). O baixo ponto de fusão do Ca(NO2)2 pode ser atribuído às ligações iônicas relativamente fracas que existem entre os íons Ca2+ e NO2-.
Densidade de nitrito de cálcio g/mL
A densidade do Ca(NO2)2 é de aproximadamente 2,32 g/mL. Este valor indica que o Ca(NO2)2 é um composto relativamente denso. A densidade é calculada dividindo a massa do composto pelo seu volume. A alta densidade de Ca(NO2)2 pode ser atribuída à presença de cátions de cálcio relativamente pesados.
Peso molecular do nitrito de cálcio
O peso molecular do Ca(NO2)2 é aproximadamente 132,09 g/mol. Este valor é calculado somando os pesos atômicos dos elementos constituintes do composto. O peso molecular é importante na determinação da quantidade de Ca(NO2)2 necessária para obter um certo número de moles do composto.
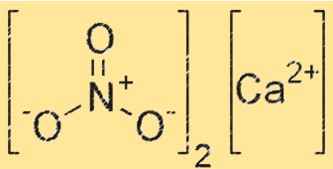
Estrutura do nitrito de cálcio
A estrutura do Ca(NO2)2 é composta por Ca2+ e NO2-. Os íons Ca2+ estão localizados no centro da rede cristalina, enquanto os íons NO2- os cercam. A estrutura cristalina é mantida unida por fortes ligações iônicas entre os íons Ca2+ e NO2-.
Solubilidade do nitrito de cálcio
Ca(NO2)2 é solúvel em água e álcool. A solubilidade em água é relativamente alta, com uma solubilidade de aproximadamente 61 g/100 ml de água à temperatura ambiente. A solubilidade em álcool é inferior à da água. A solubilidade do Ca(NO2)2 é importante para determinar sua utilização em diversas aplicações, como na produção de concreto.
| Aparência | Pó ou sólido cristalino branco a ligeiramente amarelo |
| Gravidade Específica | 2.32 |
| Cor | Incolor a branco |
| Cheiro | Inodoro |
| Massa molar | 132,09 g/mol |
| Densidade | 2,32g/ml |
| Ponto de fusão | 132°C (270°F) |
| Ponto de ebulição | Decompõe-se a aproximadamente 400°C (752°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Solúvel |
| Solubilidade | Solúvel em água e álcool |
| Pressão de vapor | Não aplicável |
| Densidade do vapor | Não aplicável |
| pKa | Não aplicável |
| pH | Neutro |
Segurança e perigos do nitrito de cálcio
O Ca(NO2)2 pode ser prejudicial se ingerido, inalado ou em contato com a pele ou os olhos. Isso pode causar irritação, queimaduras e problemas respiratórios. O composto também é um agente oxidante e pode reagir com outros produtos químicos, como ácidos e metais, para formar substâncias perigosas. O Ca(NO2)2 deve ser armazenado em local fresco, seco e bem ventilado, longe de materiais incompatíveis. Equipamentos de proteção individual, como luvas e óculos de proteção, devem ser usados ao manusear o composto. Se exposto, deve-se procurar atendimento médico imediato e remover as roupas contaminadas.
| Símbolos de perigo | Xn |
| Descrição de segurança | Evitar o contato com a pele e os olhos; usar equipamento de proteção individual (EPI); Se exposto, procure atendimento médico imediatamente. |
| Números de identificação da ONU | ONU 1454 |
| Código SH | 2834.29.90 |
| Classe de perigo | 5.1 |
| Grupo de embalagem | III |
| Toxicidade | Nocivo por ingestão ou inalação; pode causar irritação, queimaduras e problemas respiratórios |
Métodos de síntese de nitrito de cálcio
Vários métodos podem sintetizar Ca(NO2)2, incluindo a reação de ácido nítrico ou óxidos de nitrogênio com carbonato de cálcio , a reação de ácido nitroso ou óxidos de nitrogênio com hidróxido de carbono. cálcio e a reação do hidróxido de cálcio ou hidróxido de amônio com nitrato de cálcio.
Um método comum é reagir o carbonato de cálcio com ácido nítrico para produzir nitrato de cálcio. Então, a reação do nitrato de cálcio com o hidróxido de cálcio resulta na formação de subprodutos de Ca(NO2)2 e óxido de cálcio.
Outro método envolve a reação de óxidos de nitrogênio com hidróxido de cálcio para produzir Ca(NO2)2 e nitrato de cálcio.
Em outro método, pode-se reagir nitrato de cálcio com hidróxido de cálcio ou hidróxido de amônio para produzir Ca(NO2)2 enquanto gera nitrato de cálcio como subproduto.
Usos do nitrito de cálcio
Ca(NO2)2 tem diversas aplicações em diferentes indústrias, incluindo:
- Indústria do Concreto: Utilizado como aditivo ao concreto para aumentar a durabilidade e resistência das estruturas de concreto. Atua como inibidor de corrosão, protegendo o aço de reforço da corrosão causada por cloretos e outros íons agressivos.
- Agricultura: Usado como fertilizante na agricultura para fornecer uma fonte de nitrogênio e cálcio às plantas. Também usado como corretivo do solo para melhorar a qualidade do solo e promover o crescimento das plantas.
- Indústria química: utilizado como agente redutor em reações químicas, bem como precursor para a síntese de outros produtos químicos, como nitrato de cálcio e nitrato de amônio e cálcio.
- Tratamento de águas residuais: Usado como produto químico de tratamento de águas residuais para remover contaminantes e reduzir a concentração de substâncias nocivas na água.
- Indústria alimentar: utilizado como conservante alimentar para prevenir o crescimento de bactérias e outros microrganismos na carne, peixe e outros produtos alimentares.
Questões:
P: Qual é a fórmula do nitrito de cálcio?
R: A fórmula química do nitrito de cálcio é Ca(NO2)2.
P: Quanto nitrito de cálcio é usado no concreto a cada ano?
R: A quantidade de Ca(NO2)2 usada no concreto a cada ano varia dependendo da aplicação específica e da demanda do mercado. No entanto, estima-se que vários milhares de toneladas de Ca(NO2)2 sejam utilizadas em todo o mundo como aditivo para betão todos os anos.
P: O nitrito de cálcio é solúvel em água?
R: Sim, Ca(NO2)2 é solúvel em água. Possui solubilidade de aproximadamente 167 g/L a 20°C.
P: O nitrito de cálcio é um sal?
R: Sim, Ca(NO2)2 é sal. Composto iônico composto por cátions de cálcio (Ca2+) e ânions nitrito (NO2-).
P: Como as seguintes soluções seriam preparadas? 1,25 l de uma solução de 0,775 m de Ca(NO2)2
R: Para preparar 1,25 L de uma solução 0,775 M de Ca(NO2)2, você precisaria dissolver aproximadamente 187,5 g de Ca(NO2)2 em água suficiente para obter um volume final de 1,25 L. Isso pode ser calculado usando o fórmula da fórmula: gramas de soluto = Molaridade x volume (em litros) x massa molar do soluto.
P: Qual é a fórmula do composto iônico para nitrito de cálcio?
R: A fórmula do composto iônico para Ca(NO2)2 é Ca(NO2)2. É composto por um íon cálcio (Ca2+) e dois íons nitrito (NO2-).
