Nitrato de zinco (Zn(NO3)2) é um composto que contém íons zinco e nitrato. É solúvel em água e comumente utilizado em indústrias para diversas aplicações, inclusive como catalisador e na produção de corantes e pigmentos.
| Nome IUPAC | Nitrato de zinco |
| Fórmula molecular | Zn(NO3)2 |
| Número CAS | 7779-88-6 |
| Sinônimos | Dinitrato de zinco, sal de zinco de ácido nítrico, celoxano, nitrato de zinco |
| InChI | InChI=1S/2NO3.Zn/c2 2-1(3)4;/q2 -1;+2 |
Propriedades do nitrato de zinco
Fórmula de Nitrato de Zinco
A fórmula do dinitrato de zinco é Zn(NO3)2. Consiste em um íon zinco (Zn2+) e dois íons NO3- mantidos juntos por ligações iônicas. A fórmula representa a proporção dos elementos presentes no composto.
Massa molar de nitrato de zinco
A massa molar do dinitrato de zinco pode ser calculada somando as massas atômicas de seus elementos constituintes. A massa atômica do zinco (Zn) é de aproximadamente 65,38 gramas por mol, e a massa atômica do nitrogênio (N) e do oxigênio (O) nos íons NO3- é de aproximadamente 14,01 e 16,00 gramas por mol, respectivamente. Portanto, a massa molar do dinitrato de zinco é de aproximadamente 189,38 gramas por mol.
Ponto de ebulição do nitrato de zinco
O dinitrato de zinco não tem ponto de ebulição específico, pois se decompõe antes de atingir o ponto de ebulição. No entanto, quando aquecido, decompõe-se em óxido de zinco, dióxido de nitrogênio e oxigênio. Esta reação de decomposição ocorre em torno de 140°C (284°F), liberando vapores marrons de dióxido de nitrogênio.
Ponto de fusão do nitrato de zinco
O ponto de fusão do dinitrato de zinco depende do seu estado de hidratação. A forma anidra do dinitrato de zinco (Zn(NO3)2) funde a aproximadamente 238°C (460°F). No entanto, a forma hexahidratada (Zn(NO3)2·6H2O) tem um ponto de fusão inferior de cerca de 36°C (97°F) porque contém moléculas de água em sua estrutura cristalina.
Densidade de nitrato de zinco g/mL
A densidade do dinitrato de zinco varia dependendo da sua concentração e temperatura. Contudo, sob condições padrão, a densidade da forma anidra é de aproximadamente 2,065 gramas por mililitro (g/mL). A densidade da forma hexahidratada é ligeiramente maior devido à presença de moléculas de água.
Peso molecular do nitrato de zinco
O peso molecular do dinitrato de zinco é calculado somando as massas atômicas de seus elementos constituintes. O peso molecular do dinitrato de zinco é de aproximadamente 189,38 gramas por mol, conforme mencionado anteriormente.
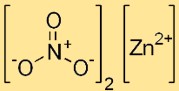
Estrutura do nitrato de zinco
O dinitrato de zinco possui estrutura iônica, com o cátion zinco (Zn2+) rodeado por seis moléculas de água na forma hexahidratada. Os íons nitrato (NO3-) estão presentes como entidades discretas na rede cristalina.
Solubilidade do nitrato de zinco
O dinitrato de zinco é muito solúvel em água. A solubilidade aumenta com a temperatura. À temperatura ambiente, aproximadamente 118 gramas de dinitrato de zinco podem dissolver-se em 100 gramas de água, resultando numa solução saturada.
| Aparência | Cristais incolores |
| Gravidade Específica | 2.065g/ml |
| Cor | Incolor |
| Cheiro | Inodoro |
| Massa molar | 189,38 g/mol |
| Densidade | 2.065g/ml |
| Ponto de fusão | 238°C (460°F) (anidro) |
| Ponto de ebulição | Decompõe-se (~140°C/284°F) |
| Ponto flash | Não aplicável |
| Solubilidade em Água | Muito solúvel em água |
| Solubilidade | Solúvel em água |
| Pressão de vapor | Não disponível |
| Densidade do vapor | Não disponível |
| pKa | Não aplicável |
| pH | ~4 (solução aquosa) |
Segurança e perigos do nitrato de zinco
O dinitrato de zinco apresenta alguns riscos de segurança que precisam ser considerados. É importante manuseá-lo com cuidado para evitar riscos potenciais. O contato com o composto pode causar irritação na pele e nos olhos. A ingestão ou inalação de dinitrato de zinco pode causar distúrbios gastrointestinais e dificuldades respiratórias. É aconselhável utilizar medidas de proteção adequadas, como luvas e óculos de proteção, ao trabalhar com dinitrato de zinco. Além disso, deve ser armazenado em local bem ventilado, longe de substâncias incompatíveis. Em caso de exposição ou ingestão acidental, recomenda-se consultar um médico. Seguir protocolos de segurança adequados garante o manuseio e uso seguros do dinitrato de zinco.
| Símbolos de perigo | Agente oxidante |
| Descrição de segurança | Causa irritação na pele e nos olhos. Evite ingestão e inalação. Manuseie com medidas de proteção adequadas. |
| Números de identificação da ONU | Nº ONU 1514 (anidro), Nº ONU 1515 (hexahidrato) |
| Código SH | 28342990 |
| Classe de perigo | 5.1 (Substâncias oxidantes) |
| Grupo de embalagem | II (anidro), III (hexahidrato) |
| Toxicidade | Moderadamente tóxico |
Métodos de síntese de nitrato de zinco
Existem diferentes métodos para sintetizar dinitrato de zinco. Uma abordagem comum é a reação entre o zinco metálico e o ácido nítrico . Neste método, o zinco reage com o ácido nítrico para produzir dinitrato de zinco e liberar gás hidrogênio. Os operadores controlam cuidadosamente a reação para manter a segurança.
Outro método envolve a reação entre o óxido de zinco e o ácido nítrico . O óxido de zinco é dissolvido em ácido nítrico, levando à formação de dinitrato de zinco e água. Este método é útil quando o óxido de zinco está prontamente disponível.
Além disso, o carbonato de zinco pode reagir com o ácido nítrico para produzir dinitrato de zinco. O carbonato reage com o ácido nítrico, formando dióxido de carbono, água e dinitrato de zinco.
É importante notar que estas reações devem ser realizadas em condições laboratoriais adequadas com as necessárias precauções de segurança. Devem ser usados equipamentos de proteção adequados, como luvas e óculos de proteção, e as reações devem ser realizadas em uma área bem ventilada.
No geral, esses métodos fornecem formas eficientes de sintetizar dinitrato de zinco, possibilitando seu uso em diversas aplicações industriais.
Usos do nitrato de zinco
O dinitrato de zinco encontra aplicações em diversas indústrias devido às suas propriedades versáteis. Aqui estão alguns usos principais do dinitrato de zinco:
- Catalisador: O dinitrato de zinco catalisa diversas reações químicas, facilitando a produção de corantes, produtos farmacêuticos e polímeros.
- Galvanoplastia: Nos processos de galvanoplastia, o dinitrato de zinco deposita uma camada de zinco nas superfícies metálicas, conferindo resistência à corrosão e melhorando a aparência.
- Pigmentos e corantes: O dinitrato de zinco atua como precursor na produção de pigmentos e corantes à base de zinco, essenciais para tintas, revestimentos e têxteis.
- Fertilizante: O dinitrato de zinco serve como fonte de zinco em fertilizantes, garantindo que as plantas recebam nutrientes suficientes para o crescimento e desenvolvimento.
- Fabricação de vidro: O dinitrato de zinco desempenha um papel fundamental na fabricação de vidro, melhorando propriedades ópticas como transparência e índice de refração.
- Tratamento de Água: O Dinitrato de Zinco desempenha um papel essencial nos sistemas de tratamento de água, controlando o crescimento de algas e bactérias e mantendo a qualidade da água.
- Reagente de Laboratório: Em vários experimentos de laboratório, o dinitrato de zinco funciona ativamente como reagente, especialmente em química analítica e pesquisa.
- Medicina e Produtos Farmacêuticos: O dinitrato de zinco contribui ativamente para certas formulações farmacêuticas e medicamentos tópicos devido às suas propriedades antimicrobianas.
- Retardadores de chama: O dinitrato de zinco é um componente chave das formulações retardantes de chama, reduzindo ativamente a inflamabilidade dos materiais.
- Indústria têxtil: Nos processos de tingimento e impressão têxtil, o dinitrato de zinco melhora ativamente a solidez da cor e melhora a absorção do corante.
Estas diversas aplicações destacam a importância do dinitrato de zinco em vários setores, contribuindo para uma gama de produtos e processos.
Questões:
P: O nitrato de zinco é solúvel?
R: Sim, o dinitrato de zinco é solúvel em água.
P: Como precipitar o carbonato de zinco a partir do nitrato de zinco?
R: Para precipitar o carbonato de zinco do Zn(NO3)2, adicione solução de carbonato de sódio ou bicarbonato de sódio à solução de dinitrato de zinco, resultando na formação de carbonato de zinco como precipitado.
P: O zinco reage com o nitrato de prata?
R: Sim, o Zn reage com o nitrato de prata, deslocando a prata metálica e formando dinitrato de zinco.
P: O nitrato de zinco é um sal?
R: Sim, o nitrato de zinco é um sal composto de cátions de zinco (Zn2+) e íons NO3-.
P: O que é formado quando o nitrato de zinco reage com o hidróxido de potássio?
R: Quando o Zn(NO3)2 reage com o hidróxido de potássio, o Zn(OH)2 precipita e forma-se nitrato de potássio.
P: Qual é a fórmula do nitrato de lítio e zinco?
R: A fórmula do dinitrato de lítio e zinco é LiZn(NO3)3.
P: Como padronizar a solução de nitrato de magnésio e nitrato de zinco?
R: Para padronizar soluções de nitrato de magnésio e dinitrato de Zn, métodos de titulação podem ser usados com um reagente padronizado apropriado.
P: Quais são os ácidos e óxidos metálicos usados para produzir nitrato de zinco?
R: O ácido nítrico (HNO3) e o óxido de zinco (ZnO) são usados para produzir dinitrato de zinco.
P: Quais produtos são produzidos quando o zinco é adicionado a uma solução de nitrato de chumbo?
R: Quando o Zn é adicionado a uma solução de nitrato de chumbo, formam-se dinitrato de zinco e chumbo metálico.
P: O que é nitrato de zinco?
R: O dinitrato de zinco é um composto químico composto de cátions de zinco (Zn2+) e ânions NO3-, frequentemente encontrados como um sólido cristalino.
P: Quantos átomos de oxigênio existem em 1,50 moles de Zn(NO3)2?
R: Em 1,50 moles de Zn(NO3)2, existem 9,00 moles ou 27,00 átomos de oxigênio.
P: Que massa de Zn(NO3)2 deve ser diluída até uma massa de 1,00 kg com H2O para preparar 97 ppm de Zn2+(aq)?
R: Para preparar uma solução contendo 97 ppm de Zn2+(aq), aproximadamente 97 mg de Zn(NO3)2 devem ser diluídos com água até uma massa de 1,00 kg.
